
题目列表(包括答案和解析)
3、下列物质不是由分子构成的是
A.二氧化硅 B.硫酸 C.蔗糖 D.C6H6
2、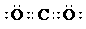 下列化学用语中正确的是
下列化学用语中正确的是
A.乙炔的最简式CH≡CH B.CO2的电子式
C.重水的分子式 T2O D.明矾的化学式 KAlSO4·12H2O
1、食品包装袋里常有作为脱氧剂或干燥剂的小包。小包内的物质不可能是
A.活性铁粉 B.生石灰 C.高锰酸钾 D.硅胶
31、现有一包铝粉和氧化铁粉末的混合物,在高温下使之充分反应。
(1)该反应的一种主要用途是: 。
(2)将反应后的固体放冷、碾细、分成两等份,进行如下实验:
ⅰ)向其中一份固体中加入100 mL 2.0 mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
ⅱ)向另一份固体中加入140 mL 4.0 mol·L-1的盐酸,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子,且pH=0。
(设固体的加入不影响溶液的体积)
①计算这包混合粉末中铝的质量和氧化铁的物质的量。
②实验ⅱ)中产生气体的体积为 L(标准状况)。
③某铝和氧化铁混合粉末15.0g 在高温下充分反应,冷却碾细后,与不同体积4.0 mol/L的盐酸作用时,产生气体的体积如下表所示:
|
实验 编号 |
混合粉末的质量 (g) |
加入盐酸的体积 (mL) |
产生气体的体积 (L,S.T.P.) |
|
A |
15.0 |
100 |
4.480 |
|
B |
15.0 |
120 |
5.376 |
|
C |
15.0 |
140 |
5.376 |
由表中数据,通过计算确定该混合粉末中铝粉和氧化铁粉末的质量比。
∴ m(Al):m(Fe2O3)=1: 。
30、YBa2Cu3Ox是一种高温超导材料,之中Y、Ba、O三种元素的化合价分别为+3、+2和-2,而Cu有+2、+3两种价态。为了求得x值
①取4.00×10-2 g YBa2Cu3Ox 样品,用稀盐酸溶解,在氩气保护下加入1 g KI固体,样品中的Cu3+和Cu2+分别与KI发生如下反应:
Cu3++3I-→CuI+I2 2Cu2++4I-→2CuI+I2
然后用0.0100mol·L-1Na2S2O3滴定生成的I2,到达滴定终点时消耗Na2S2O3溶液23.45 mL。发生的反应如下: 2Na2S2O3+ I2 → Na2S4O6+2NaI
②另取一份质量相等的YBa2Cu3Ox样品,用稀盐酸溶解,煮沸,使其中的Cu3+全部转化为Cu2+,冷却后重复①的操作,达终点时消耗Na2S2O3溶液18.13 mL。
(1) 1 mol Cu3+ 对应消耗的S2O32- 与1 mol Cu2+ 对应消耗的S2O32- 的物质的量之比是 。
(2) 4.00×10-2 g YBa2Cu3Ox中Cu3+的物质的量为 ,
Cu2+的物质的量为 。
(3) x 的值为 。
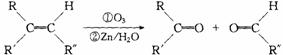
29、在一定条件下,烯烃可发生臭氧化、还原水解反应,生成羰基化合物,该反应可表示为:
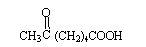
已知:6-羰基庚酸[ ]是合成某些高分子材料和药物的重要中间体。某实验室以溴代甲基环己烷为原料合成6-羰基庚酸和其他一些化合物:
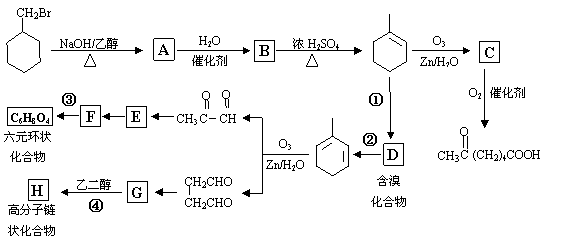
(1)写出A、B、E、H的结构简式:
A B
E H 。
(2)写出下列反应的化学方程式并注明反应条件:
② ;
③ 。
(3)写出下列反应的反应类型:① ,④ 。
28、谷胱甘肽(GSH)是体内最早发现的游离肽,可消除体内的活性氧,使酶和蛋白质免受氧化,它普遍存在于动物组织中。
 谷胱甘肽水解后产生的 HOOCCHCH2CH2COOH
,分子中官能团的名称是 ,它
谷胱甘肽水解后产生的 HOOCCHCH2CH2COOH
,分子中官能团的名称是 ,它
NH2
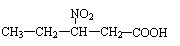 的同分异构体有很多,其中含有一个甲基、一个硝基和一个羧基的同分异构体有6种。有2种的结构简式如下:
的同分异构体有很多,其中含有一个甲基、一个硝基和一个羧基的同分异构体有6种。有2种的结构简式如下:
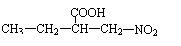
请写出另外4种同分异构体的结构简式:
、 、
、 。
27、某兴趣小组的同学们共同设计了下图所示的实验装置,既可用于制取气体,又可用于验证物质的存在。
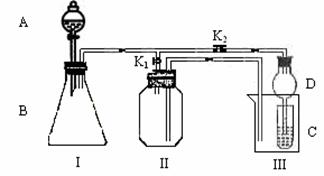
(1)甲同学认为,关闭K2,打开K1时,利用装置II可以收集H2、NH3等气体,但不能收集O2、NO等气体,其理由是: 。
乙同学认为:不改动仪器,只需要将装置II作简单改进,便可收集O2和NO等气体,但不能收集NO2气体,改进的方法是 。
(2)打开K2,关闭K1,利用I、III装置可以设计实验证明以下三种物质的氧化性强弱顺序:KMnO4>Cl2>Br2。
实验方案是:在A中加浓盐酸,B中加___________,C中加_________(均填写化学式),C中观察到的现象是_______________________________。
(3)请利用I、III装置自行设计一个证明有机物性质或结构的实验,写出实验所用的试剂的名称,简述C中的实验现象及实验结论:
A中加______________,B中加_____________,C中加 。
现象: ;
结论: 。
26、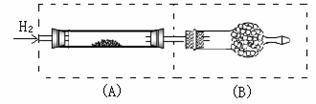 (B)
(B)
上图是甲、乙、丙三位学生为了用氢气还原氧化铜的化学原理来测定铜的相对原子质量而设计的主要实验装置(铁架台和酒精灯等略去)。实验中可称得的质量分别是:
m1、m2-分别表示未盛药品的装置A和装置B的质量。
m3、m4-分别表示加热前装置A(盛有CuO粉末)、装置B(盛有碱石灰)的质量。
m5、m6-分别表示加热后装置A及装置B(均盛有药品)的质量。
(1)甲同学在自己的实验中仅对A装置先、后称量,即求得了铜的相对原子质量。为了获得准确的实验结果,他至少应称量________次。
Cu的相对原子质量计算式为:______________。
(2)乙同学想得到铜的相对原子质量,测定了A、B两装置的有关数据,这些数据中除了m1外还必须有 ______________(从m1 ~ m6中选取)。
(3)丙同学通过实验不仅得出了铜的相对原子质量,还求出了水的组成。水的组成中n(H)/n(O)为:_____________。
(4)如果实验时所用的氢气不干燥,甲学生测得的铜的相对原子质量_______,乙学生测得的铜的相对原子质量_______(填写偏大、偏小或不变)。
(5)为了取得准确的测定结果,甲、乙、丙三位学生都需要 (填写补充实验步骤)。
考生注意:26题为分叉题,分为A B两题,考生可任选一题。若两题均做,一律按A题计分。A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
26、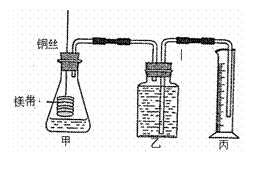 (A) 某研究性学习小组为证明“同温同 压下,相同浓度、相同体积、酸性强弱不同的一元酸与足量镁带反应,生成氢气的体积相同而反应速率不同”,设计了简易实验装置(如下图),设计的主要实验操作步骤如下:
(A) 某研究性学习小组为证明“同温同 压下,相同浓度、相同体积、酸性强弱不同的一元酸与足量镁带反应,生成氢气的体积相同而反应速率不同”,设计了简易实验装置(如下图),设计的主要实验操作步骤如下:
① ;
②量取10.00mL 0.100 mol/L盐酸,加入锥形 瓶中;
③称取除去表面氧化膜的镁带ag,绕成螺旋状,系于铜丝末端;
④在广口瓶中装足量的水,按上图连接好装置;
⑤将铜丝下移,使足量镁带浸入酸中至反应完全,记录 ;
⑥恢复到室温,读取量筒中水的体积为V mL;
⑦量取10.00mL 0.100 mol/L醋酸,在相同条件下完全重复上述实验。
请将上述空缺的实验步骤补充完整并回答下列问题:
(1)本实验中量取盐酸和醋酸溶液应选用 (填序号)。
A.10mL量筒 B.50mL量筒
C.50mL滴定管 C.10mL容量瓶
(2)步骤⑤中铜丝 (能、不能)与酸接触,理由是 。
(3)若实验结束,丙中液面高于乙中液面,读取量筒中水的体积前,应 。
(4)反应速率不等的主要原因是 ;
A.镁带纯度不同 B.操作不慎
C.溶液中c(H+)不等 D.镁带的表面积不等
(5)若水蒸气的影响忽略不计,反应中产生气体的摩尔体积的计算式为(在实验室条件下):
Vm= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com