
题目列表(包括答案和解析)
23(A)、
表中的黑线是表示元素周期表中金属元素与非金属元素的分界线。
(1)以下说法正确的是______________(填序号)
a.可在分界线附近找到制半导体材料的元素 b.可在表的右上角寻找制造农药的元素 c.除氢元素外,非金属元素原子的最外层电子数大于其电子层数
(2)已知从上到下,稀有气体元素的原子序数分别是2、10、18、36、54、86,试推测若发现117号元素,它应位于元素周期表的第_______ 周期第_______族,根据金属元素与非金属元素的分界线走势,推测该元素是__________(填“金属”、“非金属”)元素。
(3)有人认为金属元素的最高价氧化物可分为碱性氧化物、两性氧化物两大类,你认为这种看法______ (填“合理”、“不合理”) ,举一例说明__________________________ ____________________________________(若答“合理”,此空可不填)。
23(B)、下表是一些共价键键能数据(单位:kJ/mol)
|
共价键 |
键能 |
共价键 |
键能 |
共价键 |
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-O |
464 |
|
H-F |
565 |
H-Cl |
432 |
H-S |
339 |
|
C-F |
427 |
C-Cl |
330 |
C-I |
218 |
试回答下列问题
(1)以下结论肯定正确的是_________(填序号)
a.原子半径越小的原子形成的共价键越牢固
b.非金属性越强的原子形成的共价键越牢固
c.同主族元素分别与氢元素形成共价键时,原子半径越小,键越牢固
(2)请预测C-Br键的键能范围:___________< C-Br < ____________
(3)已知反应物和生成物均为气态时,化学反应的反应热等于生成物的键能总和减去反应物的键能总和。则热化学方程式 H2(g) + Cl2(g) → 2HCl(g) + a kJ中,a=______(填具体数值)kJ。
(4)卤代烃RX,在相同条件下发生碱性水解反应时(设R相同),RF、RCl、RBr、RI的反应速度由大到小的顺序为_________________________________。
24、(1)配平下列化学方程式
____ KClO3 + ____HCl → ____ClO2 + ____Cl2 +____KCl + ____H2O
反应中的氧化剂是____________ ,当有0.4molHCl参加反应时,电子转移数为_________________个。
(2)已知氧化性(酸性条件)BrO3- > IO3- >Br2 >I2 。以下方程式错误的是_______
a. IO3- + Br- → I- + BrO3-
b.6I- + BrO3- + 6H + → 3I2 + Br- + 3H2O
c.5I- + 6BrO3- + 6H + → 3 Br2 + 5 IO3- + 3H2O
d.5I- + 2BrO3- + 6H + → Br2 + IO3- + 2I2 + 3H2O
22、家用管道煤气的成分是CO、H2、CH4,10 L这种管道煤气充分燃烧,生成CO2和H2O,同温同压下消耗空气50 L(空气中氧气的体积分数为0.2)。则该管道煤气中CO、H2、CH4的物质的量之比可能是
A.1:1:1 B.3:5:4 C.2:4:5 D.1:6:4
第二卷(本卷共84分)
21、某溶液中有四种离子:NH4+、Cl-、H+、OH-,且c(NH4+)>c(Cl-)>c(OH-)>c(H+),配成该溶液的溶质可能是
A.NH4Cl B.NH4Cl和HCl C.NH4Cl 和NH3 D.NH3和HCl
20、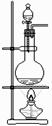
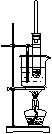 以下各实验装置中,错误的是
以下各实验装置中,错误的是
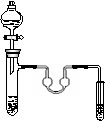
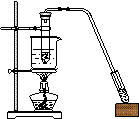
A.苯的溴化反应 B.苯的硝化反应 C.乙酸乙酯的制取 D.乙烯的制取
19、在加入铝粉能产生H2的溶液中,下列各组离子可能大量存在的是
A.NH4+、NO3-、CO32-、Na+ B.Na+、Mg2+、AlO2-、SO42-
C.Na+、Ba2+、NO3-、Cl- D.Fe2+、K+、Cl-、SO42-
18、下列化学反应的速率,前者一定大于后者的是
A.颗粒大小相同的电石分别与水和饱和食盐水反应
B.A + B 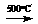 C;
D + E
C;
D + E 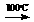 F
F
C.G + H → W + Q(Q>0),其他条件相同时分别在200℃和100℃时反应
D.纯碱和小苏打分别和相同浓度的盐酸反应
17、将a g R的氧化物R2O溶于b g水中得到澄清的溶液,欲计算R的相对原子质量,还缺少的条件是
A.溶液的体积V (mL ) B.溶质的溶解度s (g/100g水)
C.溶质的质量分数w D.溶液的物质的量浓度C(mol·L-1)
16、亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:
5HClO2 → 4ClO2↑ + H+ + Cl- + 2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,速度变化的原因是
A.逸出ClO2使生成物浓度降低 B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用 D.溶液中的Cl-起催化作用
15、三位化学家由于在烯烃复分解反应研究方面的卓越成就而获得了2005年诺贝尔化学奖。烯烃复分解反应是指相同或不同烯烃的双键在催化剂金属卡宾作用下断裂后的部分重新组合生成新物质的反应(炔烃也能发生这类反应)。例如:
CH3CH=CH2 + CH3CH=CH2
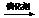 CH3CH=
CHCH3 + CH2=CH2。
CH3CH=
CHCH3 + CH2=CH2。
以下反应中不属于这类反应的是
A.CH3CH= CHCH3 + CH2=CH2 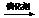 2CH3CH=CH2
2CH3CH=CH2
B.CH≡CH + CH≡CH CH2=CH-C≡CH
CH2=CH-C≡CH
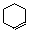 C.CH3CH2C≡CH + CH3CH2C≡CH
C.CH3CH2C≡CH + CH3CH2C≡CH CH≡CH + CH3CH2C≡CCH2CH3
CH≡CH + CH3CH2C≡CCH2CH3
D.CH2=CH-CH2-CH2-CH2-CH2-CH=CH2 CH2=CH2 +
CH2=CH2 +
14、对反应a Fe + bNO3- + cH+ → d Fe2+ + eFe3+ + f NO + gH2O,以下关系错误的是
A.c=b+2d+3e B.2d+3e=3f C.b=c+2d+3e D.3b=f+g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com