
题目列表(包括答案和解析)
6.A 7.A 8.C 9.B 10.D
1.D 2.D 3.B 4.D 5.C
32.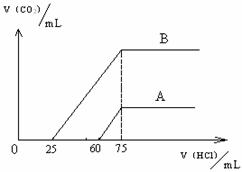 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,
所得溶液中的溶质为(写化学式) ___ ,
两种溶质的物质的量之比为 ;
加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,
所得溶液中的溶质为(写化学式) ____ ,
两种溶质物质的量之比为 ;
加盐酸后产生CO2体积最大值 mL。
(3)原NaOH溶液的物质的量浓度为__________
31.晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为_______________________________________
_________________________
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为___________________________
_______________________
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
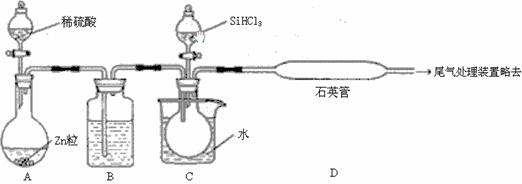
①装置B中的试剂是 。装置C中的烧瓶需要加热,其目的是_______________________
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是 。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
30.图表表示各物质之间的转化关系,已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液
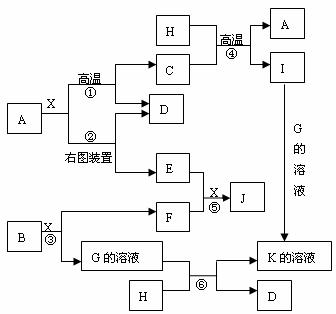
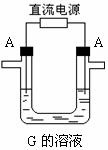
请按要求填空:
(1)B的电子式______________
(2)生成E的电极反应式:__________________________反应⑤的现象是________________
(3)反应①的化学方程式_______________在实验室引发反应④的操作是___________
(4)反应⑥的离子方程式______________
29.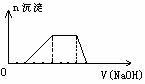 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此判断:该溶液中肯定含有的阳离子是_______________________,且各离子物质的量比_____________________ 肯定不含的阳离子是_______________________
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此判断:该溶液中肯定含有的阳离子是_______________________,且各离子物质的量比_____________________ 肯定不含的阳离子是_______________________
28.A、B、D、E是周期表中前20号元素,它们的原子序数依次增大。EA 2与水反应产生可燃性气体和白色浆状物,向该浆状物中通入AB2气体可得另一白色不溶物。B、D同主族,D的阴离子与E的阳离子具有相同的核外电子排布。请回答:
(1)已知AD2与AB2的结构相似,AD2的结构式为_________该分子是_________(填“极性分子或非极性分子”)
(2)镁条在AB2中燃烧的化学方程式为_________________________________________
(3)将D单质放入浓硝酸中加热,生成红棕色气体和一种强酸,该反应的离子方程式为_________
(4)A可形成二元弱酸H2A2O4。0.1mol H2A2O4与100mL2mol L-1的KOH溶液反应后,溶液中的离子浓度由大到小的排列顺序是_______________________________________________________
27. 在一容积为2 L且容积不变的密闭容器中加入适量碳粉和x molH2O,在800℃条件下,经10s后达到如下第一次平衡:C(s)+H2O(g) CO(g)+H2(g) ; △H>0 ,此时v(H2)=0.006mol/(L.s),
c(H2O)=0.04mol/L
在一容积为2 L且容积不变的密闭容器中加入适量碳粉和x molH2O,在800℃条件下,经10s后达到如下第一次平衡:C(s)+H2O(g) CO(g)+H2(g) ; △H>0 ,此时v(H2)=0.006mol/(L.s),
c(H2O)=0.04mol/L
请回答下列问题:
(1)加入水的物质的量x=________
(2) 若在上述平衡混合物中加入少量CaO固体,并在此温度下达到第二次平衡,则此时CO物质的量将__________(填“增大”“减小”或“不变”)
(3)若向上述第一次平衡混合物中,再充入y molCO(y<0.12),在相同条件下达到第三次平衡,则此时H2的物质的量n的取值范围是_____________________
26.请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个已配平的化学方程式。
□_________+□__________→□__________+□__________+□__________+□H2O
25.在100g浓度为18mol/L、密度为ρg/cm3 的浓硫酸中加入一定量的水稀释成9 mol/L的硫酸,则加入水的体积是
A.小于100mL B.等于100mL C.大于100mL D.等于100/ρ mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com