
题目列表(包括答案和解析)
28.(19分)
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
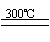 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
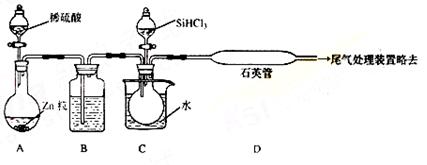
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,
装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.化学溶液 d.KSCN溶液 e.Na2SO3溶液
27.(19分)
碱存在下,卤代烃与醇反应生成醚(R-O-R′):
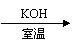
R-X+R′OH R-O-R′+HX
化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下:
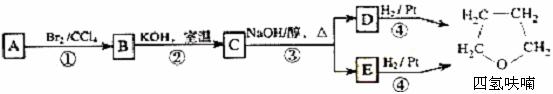
请回答下列问题:
(1)1 mol A和1 mol H2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为
A分子中所含官能团的名称是
A的结构简式为 。
(2)第①②步反应类型分别为① ② 。
(3)化合物B具有的化学性质(填写字母代号)是
a.可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
c.可发生酯化反应 d.催化条件下可发生加聚反应
(4)写出C、D和E的结构简式:
C ,D和E 。
(5)写出化合物C与NaOH水溶液反应的化学方程式:
。
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:
。
26.(14分)
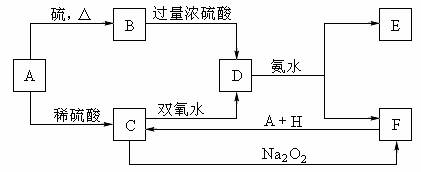
中学化学中几种常见物质的转化关系如下:
 Chenlong
Chenlong
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体E粒子直径大小的范围: 。
(2)A、B、H的化学式:A ,B ,H 。
(3)①H2O2分子的电子式:
②写出C的酸性溶液与双氧水反应的离子方程式: 。
(4)写出鉴定E中阳离子的实验方法和现象:
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式: 。
13.已知反应: ①101 kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
第Ⅱ卷(共66分)
12.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是
A.正极反应为:O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
11.某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) Z(g)+W(s);ΔH>0
Z(g)+W(s);ΔH>0
下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
10.下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
9. 下列说法正确的是
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
8. 引起下列环境污染的原因不正确的是
A.重金属、农药和难分解有机物等会造成水体污染
B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C.SO2、NO2或CO2都会导致酸雨的形成
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
7. 下列说法正确的是
A.用乙醇或CCl4可提取碘水中的碘单质
B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同
C.24Mg32S晶体中电子总数与中子总数之比为1∶1
D.H2S和SiF4分子中各原子最外层都满足8电子结构
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com