
题目列表(包括答案和解析)
9.等体积混和0.10摩/升盐酸和0.06摩/升Ba(OH)2溶液后,溶液的pH值等于
(A)2.0 (B)12.3 (C)1.7 (D)12.0
8.若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是
(A)SO42- (B)S2- (C)CO32- (D)Cl-
7.用pH试纸测定某无色溶液的pH值时,规范的操作是
(A)将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
(B)将溶液倒在pH试纸上,跟标准比色卡比较
(C)用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
(D)在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
6.在80℃时,纯水的pH值小于7,为什么?
5.将0.2摩/升CH3COOK与0.1摩/升盐酸等体积混和后,溶液中下列微粒的摩尔浓度的关系正确的是
(A)[CH3COO-]=[Cl-]=[H+]>[CH3COOH] (B)[CH3COO-]=[Cl-]>[CH3COOH]>[H+]
(C)[CH3COO-]>[Cl-]>[H+]>[CH3COOH] (D)[CH3COO-]>[Cl-]>[CH3COOH]>[H+]
4. 已知一种[H+]=1×10-3摩/升的酸和一种[OH-]=1×10-3摩/升的碱溶液等体积混和后溶液呈酸性.其原因可能是
(A)浓的强酸和稀的强碱溶液反应 (B)浓的弱酸和稀的强碱溶液反应
(C)等浓度的强酸和弱碱溶液反应 (D)生成了一种强酸弱碱盐
3.把80毫升NaOH溶液加入到120毫升盐酸中,所得溶液的pH值为2.如果混和前NaOH溶液和盐酸的摩尔浓度相同,它们的浓度是
(A)0.5摩/升 (B)0.1摩/升 (C)0.05摩/升 (D)1摩/升
2.把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化不大的是:
(A)自来水 (B)0.5摩/升盐酸
(C)0.5摩/升醋酸 (D)0.5摩/升氯化铵溶液
1.下列说法正确的是
(A)酸式盐的溶液一定显碱性
(B)只要酸与碱的摩尔浓度和体积分别相等,它们反应后的溶液就呈中性
(C)纯水呈中性是因为水中氢离子摩尔浓度和氢氧根离子摩尔浓度相等
(D)碳酸溶液中氢离子摩尔浓度是碳酸根离子摩尔浓度的二倍
29.(14分)
2 g Cu2S和CuS的混合物在酸性溶液中用400ml 0.075 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的 KMnO4恰好与350mL 0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
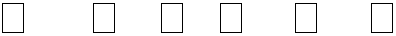
MnO4- + Fe2++ H+= Mn2++ Fe3+ + H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为 mol。
(3)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。
(4)混合物中 Cu2S的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com