
题目列表(包括答案和解析)
16.将粗铜、精铜和硫酸铜溶液组成电解池,利用电解的方法可以将粗铜提纯。下列有关粗铜精炼的叙述中,正确的是
A.粗铜连接电源的正极,发生的反应为Cu-2e- =Cu2+
B.阳极发生还原反应
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.由于阳极上铜溶解的速率与阴极上铜沉积的速率相等,所以溶液中硫酸铜的浓度基本保持不变
15.高温高压和使用催化剂的条件下,在密闭容器中发生如下反应:CO(g)+ 2H2(g)⇌ CH3OH(g)
若开始时只充入a molCH3OH气体,达至平衡时,混合物的压强比起始时增大了70%;若开始时充入a molCO和2a molH2的混合气体,达至平衡时H2的转化率为
A.30% B.35% C.65% D.70%
14.金属锂用途广泛,尤其在核工业上有着重要应用,下列关于金属锂的叙述中,正确的是
A.灼烧氯化锂时,火焰有特殊的颜色 B.氢氧化锂是弱碱
C.锂单质可以跟NaCl溶液发生置换反应 D.锂、钠、钾三种单质中,锂的熔点最低
13.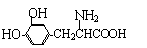 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
|
|
A.能与FeCl3溶液发生显色反应 B.能与溴水发生加成反应
C.L-多巴在空气中容易变质 D.1molL-多巴最多可以和3molNaOH反应
12.下列反应的离子方程式书写正确的是
A.小苏打溶液和甲酸钠溶液混合 HCO3-+ HCOOH = HCOO- +CO2 ↑+ H2O
B.铝片放入氢氧化钠溶液 Al + 2OH- = AlO2- + H2↑
C.次氯酸钙溶液中通入过量二氧化碳 Ca2+ +2ClO- +CO2 +H2O = CaCO3 ↓+ 2HClO
D.氨水中通入少量二氧化硫 2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
11.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所开成的化合物的性质可能有
A.能与水反应 B.能与硫酸反应 C.能与氢氧化钠反应 D.能与碳酸钠反应
10.油脂是主要的食物之一,也是一种重要的化工原料.下列说法中正确的是
A.油脂在酸性条件下水解生成甘油和肥皂
B.植物油氢化后可用作人造奶油
C.植物油不能使溴的四氯化碳溶液褪色
D.判断油脂皂化反应是否否本完成的方法是静置反应混合物观察其是否分层
9.肼(N2H4)是火箭发动机的一种燃料,反应时N2H4为氧化剂,生成N2和H2O(g)。已知:
N2(g)+2O2(g)=N2O4(g) ; ΔH=+8.7kJ·mol-1 N2H4(g)+O2(g)= N2(g)+2H2O(g);ΔH=-534.0kJ·mol-1下列表示N2H4跟N2O4反应的热化学方程式,正确的是:
A.2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g);ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g);ΔH=-1059.3kJ·mol-1
C.N2H4(g)+1/2N2O4(g) =3/2N2(g)+2H2O(g);ΔH=-1076.7kJ·mol-1
D.2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g);ΔH=-1076.7kJ·mol-1
8.下列实验操作正确的是
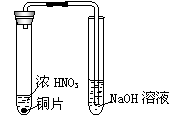 A.清洗做过银镜反应的试管前,先用浓氨水溶解管壁上的银镜
A.清洗做过银镜反应的试管前,先用浓氨水溶解管壁上的银镜
B.清洗刚制取过氨气的反应管,先用盐酸中和管内的残留固体
C.清洗刚制取过NO2的装置(右图)前,先使右管中的NaOH溶液
倒吸至左管中
D.观察铜片与浓硫酸反应后溶液的颜色,要待反应混合物冷却
至室温后,再加水稀释
7.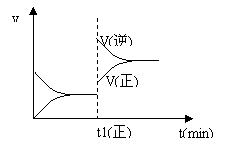 下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g) ⇌ 2SO3(g) ; ΔH<0
B.4NH3(g)+5O2(g) ⇌ 4NO(g)+6H2O(g) ; ΔH<0
C.H2(g)+I2(g) ⇌ 2HI(g) ; ΔH>0
D.C(s)+H2O(g) ⇌ CO(g)+H2(g); ΔH>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com