
题目列表(包括答案和解析)
26.(8分)某研究性学习小组选用一种硬铝合金(主要含铝、其次是镁、硅、铜)进行探究。向1.5g样品中加入足量盐酸,待反应完毕后,收集到气体1736ml(标准状况下)。将反应混合物过滤,向滤液中加入过量NaOH溶液,充分反应后再过滤;向滤液中通入足量CO2,滤出沉淀。将沉淀加热蒸干、灼烧,得白色固体2.55g,请计算这种硬铝合金中含镁的质量分数。
25. (9分)已知①苯环上新导入的取代基的位置主要与原取代剂的性质有关,把原取代基称为定位基。若定位基使新导入的取代基进入它的邻位或对位,该定位基叫作邻、对位定位基,例如烷烃基;若定位基使新导入的取代基进入它的间位,该定位基叫间位定位基,例如-NO2或-COOH
(9分)已知①苯环上新导入的取代基的位置主要与原取代剂的性质有关,把原取代基称为定位基。若定位基使新导入的取代基进入它的邻位或对位,该定位基叫作邻、对位定位基,例如烷烃基;若定位基使新导入的取代基进入它的间位,该定位基叫间位定位基,例如-NO2或-COOH
②卤代烃跟苯可发生如下反应:R-X + +HX
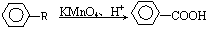 (若苯环上有间位定位基时,该反应不能发生。)
(若苯环上有间位定位基时,该反应不能发生。)
③苯的同系物可发生如下反应:
请依次写出从原料苯和乙烯出发(无机试剂任选),合成间-硝基苯甲酸的各步反应的化学方程式(其中生成-COOH 的化学方程式可不写),并注明反应条件。
24.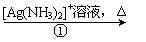 (9分)芳香族化合物A是某些植物挥发油的主要成分,其苯环上只有一个取代基,A的相对分子质量不超过150,完全燃烧只生成CO2和H2O,且分子中氧原子的质量分数为12.12%。Ae如下转化关系:
(9分)芳香族化合物A是某些植物挥发油的主要成分,其苯环上只有一个取代基,A的相对分子质量不超过150,完全燃烧只生成CO2和H2O,且分子中氧原子的质量分数为12.12%。Ae如下转化关系:
(Ⅰ)A B
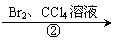

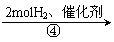
(Ⅱ)B C D E
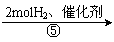
(Ⅲ)B E
根据以上信息填空:
⑴A的分子式是 A中官能团的名称是
⑵C的结构简式是
⑶写出反应⑤的化学方程式:
⑷反应③生成D的同时,是否还有可能生成别的有机物,若有,请写出其结构简式。
23.
25℃时,将体积Va,PH=a的某一元强碱与体积为Vb。PH=6的某二元强酸混合。
⑴若所得混合液的PH=11,且a=13,b=2,则Va:Vb=
⑵若所得溶液的PH=7,且已知Va〉Vb,b=0.5a,b值可否等于4(填“可”或“否”) ,其理由是 。
⑶为了更好表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg(c(H+)/c(OH-))。25。C时,若溶液呈中性,则AG= ,溶液的PH与AG的换算公式为AG= (要化简)
22.⑴-5°C时,高氙酸钠(Na4XeO6)能跟浓硫酸反应生成XeO4气体。XeO4极不稳定,固体XeO4在-40℃。C也可能发生爆炸生成氙气和氧气。请分别写出两个反应的化学方程式: ;
⑵Xe的原子序数为54,Xe核外M层和N层的电子数分别为 和 。
⑶高氙酸钠用于分析锰、铈和铬等元素,显示有突出的优越性,例如高氙酸钠在酸性溶液中能将Mn2+氧化成MnO4-,生成XeO3。高氙酸钠在水溶液中与发生了如下反应:Na4Xe06+H2O=NaOH+Na3HXeO6,请写出高氙酸钠溶液和硫酸锰的硫酸水溶液反应的离子方程式: ,若有1molNa4XeO6参加反应,转移电子 mol.
21.(8分)为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有Fe2+,按如下步骤进行操作:
第一步:对试样进行观察,说明试样中可能有Fe2+存在的外观特征是
第二步:取少量试样配成溶液,可以在此推断试样中可能含有Fe2+的现象是
第三步:操作的目的是 ,具体操作过程,现象及结论是
。
20.(16分)研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的主要步骤如下:
①各装置图所示的U开管和大烧杯中加入冷水;
②在小烧杯中按一定比例配制乙醇、水、浓硫酸混合液;
③各装置图所示的圆底烧瓶中加入一定量研细的溴化钠和少量碎瓷片;
④将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤精制溴乙烷。
回答下列问题:
⑴步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更重要的目的是
⑵步骤④加热片刻后,烧瓶内的混合物出现橘红色,出现这种现象的原因是(请用化学方程式表示) ,改用小火加热后,橘红颜色会逐渐消失,消失的原因是(请用化学方程式表示) 。
⑶为了更好的控制反应温度,除按图示小火加热,还可采用的加热方式是
。
⑷步骤⑤反应结束后,将U形管中混合物倒入分液斗中,静置,待液体分层后,弃去(填“上层”或“下层”) 液体。为了除去粗产吕中的杂质,可用下列试剂中的 (填序号)
A.氢氧化钠稀溶液 B.碳酸钠稀溶液
C.硝酸银溶液 D.四氯化碳
探究二:溴乙烷与NaOH乙醇溶液的反应
学习小组在进行溴乙烷与NaOH乙醇溶液的反应中,观察到有气体生成。
请你设计两种不同的方法分别检验该气体,并使用下列简易图标,在答题卡的方框中画出这两种方法的实验装置示意图(所给各种图标,使用次数不限,也可以不全不用),并写出装置中所盛试剂的名称(试剂任选)和实验现象。

|
|
装置示意图 |
所盛试剂 |
实验现象 |
|
1 |
|
|
|
|
2 |
|
|
|
19.背景材料:①去年12月,我省北江因某企业起标排放含镉污水,水体受到严重污染;②镉(元素符号Cd)和锌是同族元素,在自然界中镉常与锌、铅共生;③镉化合物中的硫化镉属低毒类;④专家表示“不能治一个污染又造成另一个污染”,在用药选择上,放弃了投放硫化钠的方案,使用了对人没有危害的无机高分子絮凝剂聚合硫酸铁。根据以上材料,下列相应说法正确的是
A.镉是ⅡA族的元素
B.污染物镉离子的符号是Cd3+
C.硫化镉和氢氧化镉都几乎不溶于水
D.治污的两种方案都使污染物与药剂发生氧化还原反应而除去
 第二部分 非选择题(共83分)
第二部分 非选择题(共83分)
18.几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
L |
M |
X |
R |
T |
|
原子半径(nm) |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是
A.R的氧化物对应的水化物可能具有两性 B.X单质可在氧气中燃烧生成XO3
C.离子半径大小:r(M3+)<r(T2-) D.L2+和X2-的核外电子数相等
17.下列混合溶液中,各离子浓度的大小顺序正确的是
A.浓度均为0.1mol·L-1的氨水与盐酸等体积混合 c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.浓度均为0.1mol·L-1的氯化铵溶液与氢氧化钠溶液等体积混合 c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.浓度均为0.1mol·L-1的氯化铵溶液与氢氧化钠溶液等体积混合 c(Na+)=c(Cl-)>c(OH-)>c(H+) D.10mL0.5mol·L-1的醋酸钠溶液与6mL1mol·L-1的盐酸混合c(Cl-)>c(Na+)>c(OH-)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com