
题目列表(包括答案和解析)
8 工业上用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,需把浓硝酸用等体积的水稀释。试简要回答下列问题:⑴ 用稀硝酸而不用浓硝酸的原因是 。⑵ 从经济效益和环境保护角度考虑,设计制取硝酸铜最适宜的方法,用化学方程式表示为 。
分析:⑴ 比较稀硝酸、浓硝酸分别与铜反应的方程式,Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;发现生成等物质的量的硝酸铜,用稀硝酸时,消耗原料较少,且产生污染物的量也较少。⑵ 2Cu+O2=2CuO;CuO+2HNO3=Cu(NO3)2+H2O。
4 牙膏中配有氟化物添加剂以防止龋齿的原因是,长期使用加氟牙膏在牙齿表面生成了一层质地坚硬溶解度小的氟磷酸钙。已知氟磷酸钙化学式中除钙离子外还有3个PO43–离子,一个F–离子,则其化学式是( )
A、Ca5(PO4)3F B、Ca3(PO4)3F C、Ca2(PO4)3F D、Ca6(PO4)3F
分析:根据化合价知识,易知答案为A。
5 市面上销售的金首饰是否属于纯金,可取样品与某试剂进行反应,根据现象即可判断,该试剂是( )
A、盐酸 B、硝酸 C、王水 D、硫酸
分析:本题主要考查金与酸反应的知识。能反应且现象明显的只有硝酸,所以答案为B。
6 高级轿车中装有安全气囊,内部贮存化学物质。当汽车高速前进过程中受到撞击时,化学物质会在瞬间爆发产生大量气体,充满气袋,填补在乘员与挡风玻璃、仪表板、方向盘之间,防止乘员受伤。⑴ 如果气袋内贮有硝酸铵,它受猛烈冲击后能迅速分解,产生大量N2O气体,试写出其化学方程式 。⑵ 若需要产生30dm3的N2O气体,需要贮备 mol的硝酸铵。
分析:⑴ 2NH4NO3==2N2O+4H2O。⑵ 要产生30dm3的N2O需要N2O的物质的量为30/22.4=1.34mol。由上述方程式可知,产生1molN2O需要1mol的NH4NO3,所以产生30dm3的N2O需要1.34×1=1.34(mol)的NH4NO3。
7 雷鸣电闪是日常生活中司空见惯的现象。设某次雷电中,两块云团间的电势差约为109V,放电电量约为30C。在闪电过程中,空气中有氮气和氧气直接化合,已知每摩氮气和氧气化合时要吸收180.74kJ的能量,闪电时有1/1000的能量用于这一反应。试求:⑴ 此次闪电所产生NO的物质的量为 mol。⑵ 此次雷雨闪电的生成物相当于给土壤施
了 kg尿素。
分析:⑴ 此次闪电放出的能量为E=qU=109×30=3×1010(J),根据反应方程式N2+O2=2NO,知所产生NO的物质的量为n=E总/E=3×1010×10-3×2/(180.74×103)=332(mol)。⑵ 根据氮元素守恒有关系式2NO----CO(NH2)2,可以求生成尿素的总质量为332×60/2=9960(g)=9.96kg。
3 酸雨是由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4和HNO3(主要是H2SO4)随雨水降落而形成的。为防止污染,硫酸厂用氨水来吸收SO2,离子方程式为 ;硝酸厂可用烧碱溶液来吸收氮的氧化物,如NO2被烧碱溶液吸收生成NaNO2和NaNO3,离子方程式为 ;也可用氨的催化还原法把氮的氧化物变成氮气,还原1体积的NOx需要 体积氨气。
分析:前两问的答案依次为,2NH3·H2O+SO2=2NH4++SO32-+H2O。2NO2+2OH–=NO2–+NO3–+H2O。用氨的催化还原的方程式为3NOx+2xNH3=(x+3/2)N2+3xH2O,则每还原1体积的NOx需要2x/3体积的氨气。
 1 高空大气中O2吸收紫外线可变成臭氧(O3),而冰箱中的致冷剂氟里昂在紫外线作用下分解出氯原子,氯原子能加速臭氧的分解,从而破坏平流层中的臭氧层。同样超音速飞机的尾气及发动机尾气中的NO也能加快的O3分解,反应式如下:NO+O3→NO2+2O;NO2+O→NO+O2。请你写出总的反应式:
;其中NO的作用是
和
。
1 高空大气中O2吸收紫外线可变成臭氧(O3),而冰箱中的致冷剂氟里昂在紫外线作用下分解出氯原子,氯原子能加速臭氧的分解,从而破坏平流层中的臭氧层。同样超音速飞机的尾气及发动机尾气中的NO也能加快的O3分解,反应式如下:NO+O3→NO2+2O;NO2+O→NO+O2。请你写出总的反应式:
;其中NO的作用是
和
。
分析:通过化学反应方程式的加和可以得到总的反应式:O3 O2+O。通过第一个反应式可知NO作还原剂,由总反应式可知NO作催化剂。
2 我国沿海出现了大面积赤潮,它造成的严重后果是 。赤潮是水体富营养化的结果,主要是因为滥用 等,使水中含有大量的 元素对应的离子。为了防止水污染,我国许多地区已经对洗衣粉的成分加以限制,不得再销售使用的洗衣粉中主要含有 (从下述选项中选)。
A、硅酸钠 B、烷基苯磺酸钠 C、三聚磷酸钠 D、蛋白质
分析:赤潮是红藻、蓝藻等在较短时间内大量繁殖形成的,在此期间,藻类分泌毒素,并且消耗水中的溶解氧,造成水质恶化和鱼类死亡。水体富营养化是因为滥用氮肥、磷肥、农药和城镇废水排放等,使水中含有大量的氮、磷元素。含磷洗衣粉是严禁使用的,其中含有三聚磷酸钠。
3、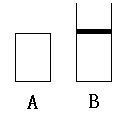 如图A、B两个容积相等的密闭容器,A能保持恒温恒容。B能保持恒温恒压,现将两个容器进行如下反应(A,B温度相等):
如图A、B两个容积相等的密闭容器,A能保持恒温恒容。B能保持恒温恒压,现将两个容器进行如下反应(A,B温度相等):
 3A(g)+B(g) 2C(g)+D(g)
3A(g)+B(g) 2C(g)+D(g)
(1)取2molC和1molD放入A中与取6molA和2molB放入A中,达平衡时,C% 大(填前者、后者、一样,下同)
(2)取3molA、2molB放入A中与取2molC、1molD放入A中达到平衡时c(D) 大。
(3)取2molC、1molD及1mol稀有气体放入A中与取2molC、1molD放入B中,达到平衡时D的转化率 大。
(4)取1.5molA、0.5molB、1molC、0.5molD放入容器A与取3molA、1molB放入容器B达到平衡时,D% 大。
2、A、B,C三个S02和02的气体反应体系,其中所含S02和02的物质的量依次为:2和l、2和3、4和6,分别在总体积不变和恒温的条件下进行S02的催化氧化,直至建立平衡。已知A的平衡体系的SO2转化率大于60%,试比较A、B、C三个平衡体系的:
(1)S02的转化率的大小; (2)02消耗率的大小。
1.在某条件下,容器中有如下平衡反应: 。
 A+4B 2C+D,△H<0;此时,A 、B、C的物质的量均为amol,而D的物质的量为dmol。
A+4B 2C+D,△H<0;此时,A 、B、C的物质的量均为amol,而D的物质的量为dmol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a的取值范围应是 (用a和d的关系式表示)。
(2)如果要使反应重新建立的平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是 (从下面列出的选项中选择)
(A)升高反应温度 (B)增大反应容器之压强 (C)增大反应容器之容积(D)降低反应温度 (E)减小反应容器之压 (F)减小反应容器之容积
7. A和B两个容积完全相同的容器中,A中充有各1g的二氧化硫和氧气,B中充有各2g的二氧化硫和氧气。在同温下,反应达到平衡,设此时A中二氧化硫的转化率为a%,B中二氧化硫的转化率为b%,则其大小关系是( )
A.a%>b% B. a%≥b% C. a%<b% D. a%≤b%
反馈练习
6. 一定温度下,在容积不变的密闭容器中,存在着N2O4 2NO2 的平衡体系中,充入NO2或N2O4,则N2O4的转化率如何变化。
一定温度下,在容积不变的密闭容器中,存在着N2O4 2NO2 的平衡体系中,充入NO2或N2O4,则N2O4的转化率如何变化。
4.一定温度下,两个在容积均为1L的密闭容器A和B中,分别充入1molHI和2molHI,达到平衡时,HI的转化率分别为x%和y%,试比较x和y的大小
小结:
思维方法之四:扩大缩小
练习:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com