
题目列表(包括答案和解析)
6.常温下,已知1L溶液中已电离的水的物质的量是10-11mol ,在此溶液中肯定能大量共存的离子组是
A.K+、Na+、NO3-、Cl- B. CO32-、Cl-、Na+、K+
C.Mg2+、NO3-、K+、Cl- D. NO3-、NH4+、SO42-、K+
 ①单质与氧化物发生置换反应
①单质与氧化物发生置换反应
2Na+2H2O = 2NaOH+H2 2Mg+CO 2 = 2MgO+C

 3Fe+4H2O(g)
= Fe3O4+4H2
H2+CuO=
Cu+H2O
3Fe+4H2O(g)
= Fe3O4+4H2
H2+CuO=
Cu+H2O


 C+FeO = Fe+CO
2F2+2H2O=
4HF+O2
C+FeO = Fe+CO
2F2+2H2O=
4HF+O2

 2C+SiO2=
Si+2CO
2Al+Fe2O3 = Al2O3+2Fe
2C+SiO2=
Si+2CO
2Al+Fe2O3 = Al2O3+2Fe


 C+H2O=
CO+H2 2H2+SiCl4=Si+4HCl
C+H2O=
CO+H2 2H2+SiCl4=Si+4HCl
Si+2FeO =2Fe+SiO2 3 H2+Fe2O3 = 2Fe+3H2O
 ②单质与非氧化物发生置换反应
②单质与非氧化物发生置换反应

 2H2+SiCl4
=Si+4HCl
H2S+Cl2 = S+2HCl
2H2+SiCl4
=Si+4HCl
H2S+Cl2 = S+2HCl
 3Cl2+8NH3
= 6NH4Cl+N2
4NH3+3O2 =2N2+6H2O
3Cl2+8NH3
= 6NH4Cl+N2
4NH3+3O2 =2N2+6H2O


 Mg+2HCl = MgCl2+H2
2Al+6HCl = 2 AlCl3+3H2
Mg+2HCl = MgCl2+H2
2Al+6HCl = 2 AlCl3+3H2
10、特殊的实验现象
⑴焰色及有色物质
⑵遇酚酞显红色的气体:NH3(碱性气体)
⑶遇空气变为红棕色的气体:NO
⑷加碱产生白色沉淀,迅速变成灰绿色,最终变成红褐色,必有Fe2+
⑸加苯酚显紫色或加SCN-显血红色或加碱产生红褐色沉淀,必有Fe3+
⑹遇BaCl2生成不溶于硝酸的白色沉淀,可能是:SO42-、Ag+、 SO32-
⑺遇HCl生成沉淀,可能是:S2O32-、Ag+、 SiO32-、AlO2-
⑻遇H2SO4生成沉淀,可能是:Ba2+、Ca2+、S2O32-、SiO32-、AlO2-
⑼具有臭鸡蛋气味的气体H2S,与H2S反应生成淡黄色沉淀的气体有Cl2、O2、SO2、NO2
⑽电解时阳极产生的气体一般是:Cl2、O2,阴极产生的气体是:H2
⑾能使品红溶液褪色的气体可能是:Cl2、SO2,物质可能有:NaClO、Ca(ClO)2等次氯酸盐、氯水、过氧化钠、过氧化氢、活性碳等
⑿气体单质:H2、O2、Cl2、N2、F2
⒀固体加热产生的气体:O2、NH3、CH4、HCl

 ①同主族元素单质间的置换
①同主族元素单质间的置换

 Na+KCl = NaCl+K
2Na+2H2O = 2NaOH+H2
Na+KCl = NaCl+K
2Na+2H2O = 2NaOH+H2

 2H2S+O2
= 2S+2H2O
2C+SiO2 = Si+2CO
2H2S+O2
= 2S+2H2O
2C+SiO2 = Si+2CO
Cl2+2HI = 2HCl+I2 F2+2HCl= 2HF+Cl2

 ②不同主族元素单质间的置换
②不同主族元素单质间的置换
Mg+2HCl =MgCl2+H2 2Mg+CO 2 = 2MgO+C


 2Al+6HCl = 2AlCl3+3H2 2F2+2H2O
= 4HF+O2 C+H2O
= CO+H2
2Al+6HCl = 2AlCl3+3H2 2F2+2H2O
= 4HF+O2 C+H2O
= CO+H2


 2H2+SiCl4
= Si+4HCl H2S+Cl2
= S+2HCl 3Cl2+8NH3
= 6NH4Cl+N2
2H2+SiCl4
= Si+4HCl H2S+Cl2
= S+2HCl 3Cl2+8NH3
= 6NH4Cl+N2
 4NH3+3O2 = 2N2+6H2O
4NH3+3O2 = 2N2+6H2O
③主族元素单质置换副族元素的单质

 H2+CuO=Cu+H2O
2Al+Fe2O3
= Al2O3+2Fe
H2+CuO=Cu+H2O
2Al+Fe2O3
= Al2O3+2Fe

 C+CuO =Cu+CO
2Al+3Hg2+ =2Al3++3Hg
C+CuO =Cu+CO
2Al+3Hg2+ =2Al3++3Hg
 Na+TiCl4
=4NaCl+Ti
Na+TiCl4
=4NaCl+Ti
④副族元素的单质置换主族元素单质

 3Fe+4H2O(g)
=Fe3O4+4H2 Zn+2H+
=Zn2++H2
3Fe+4H2O(g)
=Fe3O4+4H2 Zn+2H+
=Zn2++H2
⑤副族元素的单质置换副族元素的单质
 Fe+CuSO4 =FeSO4+Cu
Fe+CuSO4 =FeSO4+Cu
①金属单质置换金属单质
 2Al+Fe2O3
Al2O3+2Fe
2Al+Fe2O3
Al2O3+2Fe
 (铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换)
(铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换)
Fe+CuSO4 = FeSO4+Cu
 ②金属单质置换非金属单质
②金属单质置换非金属单质
 2Na+2H2O = 2NaOH+H2 2Mg+CO 2 = 2MgO+C
2Na+2H2O = 2NaOH+H2 2Mg+CO 2 = 2MgO+C
 3Fe+4H2O(g) = Fe3O4+4H2
3Fe+4H2O(g) = Fe3O4+4H2
 ③非金属单质置换金属单质
③非金属单质置换金属单质

 H2+CuO=Cu+H2O C+FeO = Fe+CO
Si+2FeO =2 Fe+SiO2
H2+CuO=Cu+H2O C+FeO = Fe+CO
Si+2FeO =2 Fe+SiO2
 ④非金属单质置换非金属单质
④非金属单质置换非金属单质

 2F2+2H2O=
4HF+O2
2C+SiO2 = Si+2 CO
2F2+2H2O=
4HF+O2
2C+SiO2 = Si+2 CO
 C+H2O = CO+H2
2H2+SiCl4 = Si+4HCl
C+H2O = CO+H2
2H2+SiCl4 = Si+4HCl
5. 在温度、压强不变的条件下,只要投入的原料经过转化以后成比例,则容器内各组分的百分含量相同,各指定物质的物质的量浓度也相同。
一定温度下,在一个固定体积的密闭容器中进行可逆反应:mA+nB 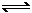 pC+qD。如果两次反应投入原料物质不同,而反应达到平衡时,指定物质的浓度相同,则经过配比转化后的原料不仅完全成比例,而且物质的量完全相同。
pC+qD。如果两次反应投入原料物质不同,而反应达到平衡时,指定物质的浓度相同,则经过配比转化后的原料不仅完全成比例,而且物质的量完全相同。
例6:温度一定,在一个密闭容器内,发生合成氨反应:N2+3H2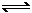 2NH3。若充入1molN2和3molH2,反应达到平衡时NH3的体积百分含量为W%。若改变开始时投入原料的量,加入amolN2,bmolH2,cmolNH3,反应达到平衡时,NH3的体积百分含量仍为W%,则:
2NH3。若充入1molN2和3molH2,反应达到平衡时NH3的体积百分含量为W%。若改变开始时投入原料的量,加入amolN2,bmolH2,cmolNH3,反应达到平衡时,NH3的体积百分含量仍为W%,则:
① 若温度、容器体积恒定a=b=0, c=
若温度、压强恒定a=b=0, c
② 若温度、容器体积恒定a=0.75, b= , c=
若温度、压强恒定a=0.75, b , c
③ 若温度、压强恒定,则 a、b、c之间必须满足的关系是
例7:保持恒温恒压,向容积可变的密闭容器中充入3LA和2LB,发生如下可逆反应:
3A(气) + 2B(气)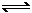 xC(气)
+ yD(气)。
达到平衡后,C 的体积分数为m% 。若维持温度和压强不变,将0.6LA,0.4LB,4LC,0.8LD作为起始物质充入该密闭容器,达到平衡时使C的体积分数仍为m%。请回答:能否计算出x、 y的值,如果可以,请写出计算过程;如果不能,请说明理由,并写出x y应满足的等量关系。
xC(气)
+ yD(气)。
达到平衡后,C 的体积分数为m% 。若维持温度和压强不变,将0.6LA,0.4LB,4LC,0.8LD作为起始物质充入该密闭容器,达到平衡时使C的体积分数仍为m%。请回答:能否计算出x、 y的值,如果可以,请写出计算过程;如果不能,请说明理由,并写出x y应满足的等量关系。


 例8:如图,一定温度下,把2体积N2和6体积H2通
例8:如图,一定温度下,把2体积N2和6体积H2通
 入一个带有活塞的体积可变的容器内,活塞的一端与大 2体积N2
大
入一个带有活塞的体积可变的容器内,活塞的一端与大 2体积N2
大
气相通。容器中发生以下反应:N2+3H2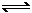 2NH3。当 和6体积H2 气
2NH3。当 和6体积H2 气
反应达到平衡时,测得混合物的体积为7体积。
 请回答以下问题:
请回答以下问题:
(1)保持上述反应温度不变,设a、b、c分别代表初始时的N2、H2和NH3的体积,反应达到平衡时,混合气体中各物质的百分含量与上述平衡相同。
①若a=1, c=2则b= 。在此情况下,反应起始时将向 方向移动。
② 若规定起始时反应向逆反应方向进行,则此情况下c 的取值范围是 。
(2)在上述装置中,若控制反应达到平衡时混合气体的体积是6.5体积,则可采取的措施是 ,原因是 。
4. 在恒温、定容条件下,对于类似H2+I2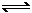 2HI的反应前后气体体积不变且方程式的一边只有一种物质的反应:
2HI的反应前后气体体积不变且方程式的一边只有一种物质的反应:
①如果不加入单一反应物(HI),而同时加入非单一反应物(例如加入H2和I2),如果这两次的反应物的量成比例,也能使各组分的体积百分含量恒定。
② 如果加入的物质在反应方程式的两侧都有,则把单一反应物按照方程式的系数比转化为方程式一侧的几种反应物,如果能使这些反应物经过配比转化后的物质的量几次成比例,则也能使各组分的体积百分含量恒定。
例4:在一个固定体积的密闭容器内,保持一定的温度发生以下反应:H2+Br2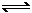 2HBr。已知加入1molH2和2molBr2 时,达到平衡状态生成amolHBr。在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
2HBr。已知加入1molH2和2molBr2 时,达到平衡状态生成amolHBr。在相同条件下,且保持平衡时的各物质的百分含量相同,则填写下列空白:
|
编号 |
起始状态(mol) |
平衡时HBr 物质的量(mol) |
||
|
H2 |
Br2 |
HBr |
||
|
已知 |
1 |
2 |
0 |
a |
|
① |
2 |
4 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
n(n≥2m) |
|
|
例5:有两个起始体积相同的密闭容器A和B,A容器中有一个可自由移动的活塞,能使该容器内始终保持恒压,B容器为固定体积的容器。起始时向这两个容器内分别充入等量的体积比为2 : 1的SO2和O2的混合气体,并使A、B两容器的体积相等。在保持400℃的合成条件下,使如下反应:2SO2+O2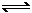 2SO3达到平衡。请回答:
2SO3达到平衡。请回答:
(1)达到平衡所用的时间A容器比B容器 ,两容器中SO2的转化率A比B 。
(2)达到(1)所述的平衡后,若向两容器内通入等量的原反应混合气,则重新达到平衡后,A容器中SO3的百分含量 ;B容器中SO3的百分含量 (增大、减小、不变)。
3. 对于在固定容积的容器内进行的反应前后气体体积改变的反应,如果反应达到平衡时,各组分的体积百分含量相同,则各指定物质的物质的量浓度相同。
例3:在一个真空固定体积的密闭容器内,充入10molN2和30molH2,发生合成氨反应:N2+3H2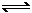 2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
2NH3,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成份的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是( )
A、15mol 25% B、20mol 50% C、20mol 75% D、40mol 80%
2. 在恒温、定容条件下,对于类似H2+I2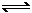 2HI的反应前后气体体积不变且方程式的一边只有一种物质的反应,只要方程式的另一边的几种反应物质的物质的量与方程式的系数成正比,无论加入多少量的生成物(在方程式的这一侧只有这种物质);或只加入这种单一反应物质(如HI),而另几种反应物的量为0,都能使反应达到平衡时,各组分的体积百分含量恒定。
2HI的反应前后气体体积不变且方程式的一边只有一种物质的反应,只要方程式的另一边的几种反应物质的物质的量与方程式的系数成正比,无论加入多少量的生成物(在方程式的这一侧只有这种物质);或只加入这种单一反应物质(如HI),而另几种反应物的量为0,都能使反应达到平衡时,各组分的体积百分含量恒定。
例2:在一个固定容积的密闭容器内,发生反应:3X+2Y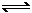 xZ。若初始时加入3mol的X,2mol的Y,则反应达到平衡时,Z 的百分含量为W%;维持温度和容器的体积不变,若初始时加入的物质为0.6molX,0.4molY,0.8molZ,反应达到平衡时,Z的百分含量仍为W%。求x的值。
xZ。若初始时加入3mol的X,2mol的Y,则反应达到平衡时,Z 的百分含量为W%;维持温度和容器的体积不变,若初始时加入的物质为0.6molX,0.4molY,0.8molZ,反应达到平衡时,Z的百分含量仍为W%。求x的值。
1. 对于在固定容积的容器内进行的反应前后气体体积不变的反应,只要初始时加入的原料符合方程式的系数之比,则反应达到平衡时,各组分的体积百分含量恒定。但是指定物质的浓度不一定相同。
例1:在一定容积的密闭容器内,发生反应:H2+I2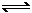 2HI 。
2HI 。
① 若初始时加入1mol的HI,则反应达到平衡时,HI的体积百分含量为W%。
② 若初始时加入2mol的HI,则反应达到平衡时,HI的体积百分含量与W%相比 。
9 HNO3是极其重要的化工原料。工业上制备HNO3是采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的(假定上述过程的每一步反应中无其它损失)。⑴试写出上述反应的化学方程式。⑵设循环操作的次数为n,试计算一定量的NO2气体要经过多少次循环操作才能使95%的NO2转变为硝酸?⑶将上述方法制备的硝酸稀释或蒸馏、浓缩,可以得到不同浓度的硝酸。实际上,不同浓度的硝酸与同一种金属反应可生成不同的还原产物。如图是镁与硝酸反应,各产物及含量随硝酸浓度变化的情况(当硝酸浓度小于10mol·L-1时还有NH4+生成),写出镁与11mol·L-1硝酸反应的化学方程式。⑷960mg镁与100mL4mol·L-1硝酸溶液恰好完全反应,收集到224mL气体(STP),试写出该反应化学方程式。
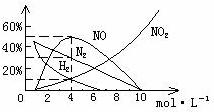
分析:⑴ 3NO2+H2O=2HNO3+NO,2NO+O2=2NO2。⑵ 从反应式可知,NO2跟水第一次反应中有2/3转化为硝酸,经循环氧化后所得的NO2跟水第二次反应中有2/3×1/3转化为硝酸……,那么,经n次循环后转化为硝酸的总量:S=2/3+2/3×1/3+2/3×(1/3)2+2/3×(1/3)3……+2/3×(1/3)n=1-(1/3)n,列式,1-(1/3)n=95%,解得n≈3。⑶ 看图,当硝酸的浓度超过10mol·L-1时,还原产物只有NO2,所以,其反应方程式为:Mg+4HNO3=Mg(NO3)2+2NO2↑+2H2O。⑷ 看图,当硝酸跟4mol·L-1硝酸反应时,生成的NO、NO2、H2、N2的物质的量之比为5﹕1﹕1﹕3,又据题意,当硝酸浓度小于10mol·L-1时还有NH4+生成,所以,其反应方程式为:40Mg+100HNO3=5NO+H2+NO2+3N2+4NH4NO3+40Mg(NO3)2+41H2O。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com