
题目列表(包括答案和解析)
2、下列叙述正确的是
A、同主族金属的原子半径越大熔点越高 B、稀有气体原子序数越大沸点越高 C、分子间作用力越弱分子晶体的熔点越低 D、同周期元素的原子半径越小越易失去电子 3、关于晶体的下列说法正确的是 A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子 C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低 4、x、y、z为短周期元素,这些元素原子的最外层电子数分别是1、4、6.则由这三种元素组成的化合物的化学式不可能是 A.XYZ B.X2YZ C.X2YZ2 D.X2YZ3 5、下列化学式既能表示物质的组成,又表示物质分子式的是
(A) NH4NO3 (B) SiO2 (C) C6H5NO2 (D) Cu
1、X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为 A、XY B、XY2 C、XY3 D、X2Y3
(三) 溶液计算
1. 基本公式及关系:
基本公式及关系:
(1)物质的量浓度:
①。
②稀释过程中溶质不变:C1V1=C2V2。
③同溶质的稀溶液相互混合:C混=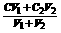
④质量分数换算为物质的量浓度:C=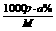
(2)溶质的质量分数。
①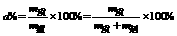
② (饱和溶液,S代表溶质该条件下的溶解度)
(饱和溶液,S代表溶质该条件下的溶解度)
③混合:m1a1%+m2a2%=(m1+m2)a%混
④稀释:m1a1%=m2a2%
(3)有关溶解度的计算:
①S=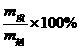 (饱和溶液:一定温度下)
(饱和溶液:一定温度下)
②S= (a%:饱和溶液质量分数)
(a%:饱和溶液质量分数)
③有关pH值的计算:酸算H+,碱算OH-
Ⅰ. pH= -lg[H+]
Ⅱ. KW=[H+][OH-]=10-14(25℃下)
考试注意:
1. 要抓住关键字在题目的问题中,通常出现如下词:正确与错误、大与小、强与弱、能与否,由强到弱或由弱到强,名称与符号,分子式、结构简式、电子式,化学方程式与离子方程式等,即使题目会做,由于不注意上述词语,就有可能造成失分。
2. 注意各量的单位物质的量浓度(mol/L),摩尔质量(g/mol),深解度(g)、百分数、浓度互换时的体积易错等。
3. 题目中隐含性的限制条件如(1)酸性的无色透明溶液,(2)PH=0的溶液(3)水电离出的[OH-]=10-14mol/L的溶液等
4. 注意常见符号的应用如"=",可逆符号、"△H>0"、"△H<0"、沉淀、气体符号,电荷与价标、写电子式时"[ ]"的应用、物质的聚集状态、特殊的反应条件等等。
5. 实验填空题或简答题,注意文字要准确(1)不要用错别字:如脂与酯、铵与氨、坩与甘、蘸与粘、蓝与兰、褪与退、溶与熔、戊与戌、催与崔、苯与笨等。(2) 不用俗语:如a、打开分液漏斗的开关(活塞),b、将气体通进(入)盛溴水的洗气瓶,c、酸遇石蕊变红色(酸使石蕊呈红色)等。
考前叮咛(打油诗一首)
各位同学要牢记,一看二审三注意:拿到试卷别慌忙,首先看有多少题。
检查试卷齐全否,前后页码看仔细;答题记号搞明确,单选多选莫麻痹!
铃声未响不许做,不妨用手作标记。题多时少巧安排,先易后难细审题。
找出解题突破口,选对选错莫岔题!关键字词要抓稳,文字书写要麻利;
专用名词切莫错,代号符号要规矩。若是碰上栏路虎,一时半刻想不起,
不如暂时放一边,先做把握最大的。单选填空和推断,一般没有大问题;
遇到多选组合判,千万小心别轻敌!力争做到稳准狠,一次成功最省力。
现在时兴新情境,变换花样考能力。此类多是纸老虎,故弄玄虚吓唬你。
首先安慰你自己:没有什么了不起!读懂题目玄机现,顺藤摸瓜不费力。
多数计算可巧解:画出流程找关系,物料电荷皆守恒,寻找捷径来解题。
最后一道综合题,题巧分重拉距离。先把题目读两遍,再做两次深呼吸;
化整为零分步做,设计未知列比例;公式定理要活用,引入数据要合理;
步骤书写要规范,做完作答别忘记;还有单位小数点,这些扣分太可惜!
难题最后来攻克,信心百倍难变易。时间若是有富余,首先检查分多的,
不到最后不交卷,出场后悔就晚矣!时间多数不够用,千万不要干着急,
首先扫清空白点,连猜带估写上去!多选若是拿不准,只填一个保险的。
能写几步是几步,多得一分压一批!高考一科接一科,出了考场别再提。
讨论对答猜分数,考试期间不可取!若有这些闲功夫,不如睡觉养精力。
考试往往靠发挥,技巧用活出成绩。心理素质很重要,劝君早日作练习。
别人劝告是外因,关键还靠你自己。家长老师在祈祷,祝愿你们创奇迹!
(一)有关化学式的计算
1.通过化学式,根据组成物质的各元素的原子量,直接计算分子量。
2.已知标准状况下气体的密度,求气体的式量:M=22.4ρ。
3.根据相对密度求式量:M=MˊD。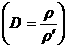
4.由气态方程求式量:M=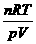
5.混合物的平均分子量:

6.原子量
①原子的原子量=
②质量数=质子数+中子数
③元素原子量: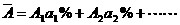
A1、A2表示同位素原子量,a1%、a2%表示原子的摩尔分数
④元素近似原子量: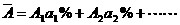
A1、A2表示同位素原子量,a1%、a2%表示原子的摩尔分数
②对气体使用体积时注意条件(温度及压强),否则气体体积无意义
Ⅴ、化学计算
酯的水解(70-80℃)、硝酸钾溶解度的测定(室温-100℃)需用温度计来控制温度;银镜反应需用温水浴加热即可。
(二)无机
1. 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物);
2. 亚铁盐及氢氧化亚铁;
3. -2价硫的化合物(H2S、氢硫酸、硫化物);
4. +4价硫的化合物(SO2、H2SO3及亚硫酸盐);
5. 双氧水(H2O2,其中氧为-1价)
※注:苯的同系物被KMnO4(H+)溶液氧化的规律:
侧链上与苯环直接相连的碳原子被氧化成羧基,其他碳原子则被氧化成CO2。
倘若侧链中与苯环直接相连的碳原子上没有氢,则不能被氧化。


如:
Ⅳ、化学实验:
不宜长期暴露空气中的物质
1.由于空气中CO2的作用:
生石灰、NaOH、Ca(OH)2溶液、Ba(OH)2溶液、NaAlO2溶液、水玻璃、碱石灰、漂白粉、苯酚钠溶液、Na2O、Na2O2;
2.由于空气中H2O的作用:
浓H2SO4、P2O5、硅胶、CaCl2、碱石灰等干燥剂、浓H3PO4、无水硫酸铜、CaC2、面碱、NaOH固体、生石灰;
3.由于空气中O2的氧化作用:
钠、钾、白磷和红磷、NO、天然橡胶、苯酚、-2价硫(氢硫酸或硫化物水溶液)、+4价硫(SO2水溶液或亚硫酸盐)、亚铁盐溶液、Fe(OH)2。
4.由于挥发或自身分解作用:
AgNO3、浓HNO3、H2O2、液溴、浓氨水、浓HCl、Cu(OH)2。
 化学实验设计思维模型:
化学实验设计思维模型:
实验中水的妙用
(一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 苯的同系物;※
3. 不饱和烃的衍生物(烯醇、烯醛、烯酸、卤代烃、油酸、油酸盐、油酸酯等);
4. 含醛基的有机物(醛、甲酸、甲酸盐、甲酸某酯等);
5. 酚类
6. 石油产品(裂解气、裂化气、裂化汽油等);
7. 煤产品(煤焦油);
8. 天然橡胶(聚异戊二烯)。
(二)无机
1. -2价硫(H2S及硫化物);
2. +4价硫(SO2、H2SO3及亚硫酸盐);
3. +2价铁:
 6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
6FeSO4+3Br2=2Fe2(SO4)3+2FeBr3
6FeCl2+3Br2=4FeCl3+2FeBr3 变色
2FeI2+3Br2=2FeBr3+2I2
4.Zn、Mg等单质 如Mg+Br2MgBr2
(此外,其中亦有Mg与H+、Mg与HbrO的反应)
5.-1价的碘(氢碘酸及碘化物) 变色
6.NaOH等强碱:Br2+2OH‾==Br‾+BrO‾+H2O
7.Na2CO3等盐:Br2+H2O==HBr+HBrO
2HBr+Na2CO3==2NaBr+CO2↑+H2O
HBrO+Na2CO3==NaBrO+NaHCO3
8.AgNO3
能萃取溴而使溴水褪色的物质
上层变无色的(ρ>1):卤代烃(CCl4、氯仿、溴苯等)、CS2;
下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、液态环烷烃、低级酯、液态饱和烃(如已烷等)等
能使酸性高锰酸钾溶液褪色的物质
(一)有机
1. 不饱和烃(烯烃、炔烃、二烯烃、苯乙烯等);
2. 不饱和烃的衍生物(烯醇、烯醛、油酸、油酸盐、油酸某酯、油等)
3. 石油产品(裂化气、裂解气、裂化汽油等);
4. 苯酚及其同系物(因为能与溴水取代而生成三溴酚类沉淀)
5. 含醛基的化合物
6. 天然橡胶(聚异戊二烯)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com