
题目列表(包括答案和解析)
8、在一定温度下,向a L密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应:
X(g) + 2Y(g) 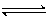 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
A.容器内压强不随时间变化 B.容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为l : 2 : 2 D.单位时间消耗0.1 mol X同时生成0.2 mol Z
7、对已达化学平衡的下列反应2X(g)+Y(g)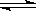 2Z(g)减小压强时,对反应产生的影响是
2Z(g)减小压强时,对反应产生的影响是
A 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C 正、逆反应速率都减小,平衡向逆反应方向移动
D 正、逆反应速率都增大,平衡向正反应方向移动
6、同温同压下,当反应物分解了8%时,总体积也增加8%的是
A.2NH3(g)  N2(g)+3H2(g) B.2NO(g)
N2(g)+3H2(g) B.2NO(g)  N2(g)+O2(g)
N2(g)+O2(g)
C.2N2O5(g)  4NO2(g)+O2(g) D.2NO2(g)
4NO2(g)+O2(g) D.2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
4、可逆反应:3A(气) 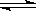 3B(?)+C(?),△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
3B(?)+C(?),△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是
(A) B和C可能都是固体 (B) B和C一定都是气体
(C)若C为固体,则B一定是气体 (D) B和C可能都是气体
5、对于反应2SO2+O2
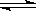 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A 2体积2SO2和足量O2反应,必定生成2体积SO3
B其他条件不变,增大压强,平衡必定向右移动
C平衡时,SO2消耗速度必定等于O2生成速度的两倍
D平衡时,SO2浓度必定等于O2浓度的两倍
3、在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应
2R(气)+5Q(气)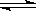 4X(气)+nY(气)
反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
A、2 B、3 C、4 D、5
4X(气)+nY(气)
反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
A、2 B、3 C、4 D、5
2、体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2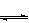 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
A、等于p% B、大于p% C、小于p% D、无法判断
1、将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应
2A气)+B(气)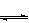 2C(气)若经2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(气)若经2 s(秒)后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70% ④2 s时物质B的浓度为0.7 mol/L其中正确的是
A.①③ B.①④ C.②③ D.③④
7、用惰性电极实现电解,下列说法正确的是
A 电解稀硫酸溶液,实质上是电解水,故溶液p H不变
 B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
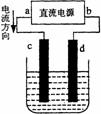
D 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 8、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列判断正确的是
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加 D 电解过程中,氯离子浓度不变
化学反应速率、化学平衡类
5、用惰性电极电解M(NO3)x的水溶液,当阴汲上增重ag时,在阳极上同时产生bL氧气(标准状况):从而可知M的原子量为 A.22.4ax/b B、11.2ax/b C.5.6ax/b D.2.5ax/b 6、用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是
A.稀NaOH溶液 B.HCl溶液 C.酸性MgSO4溶液 D.酸性AgNO3溶液
4、将质量分数为0.052(5.2%)的NaOH溶液1升(密度为1.06克/毫升)用铂电极电解,当溶液中的NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是
|
|
NaOH的质量分数 |
阳极析出物的质量(克) |
阴极析出物的质量(克) |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com