
题目列表(包括答案和解析)
6、已知 I-、Fe2+、SO 2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为 Cl-< Fe 2+< H2O 2 < I-< SO 2,则下列反应不能发生的是( CD)
(A)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (B)I2+SO2+2H2O=H2SO4+2HI
(C)H2O2+H2SO4=SO2+O2+2H2O (D)2Fe2++I2=2Fe3++2I-
5、常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是( C )
(A)②④⑥ (B)①③④ (C)①③⑤⑥ (D)②⑤
4、下列有关阿伏加德罗常数的叙述正确的是( A )
(A)标准状况下,以任意比混合的甲烷和丙烷混合气体22.4L所含分子数为NA个
(B)1mol冰醋酸中含有6.02×1023个CH3COO-
(C)电解饱和食盐水时,每得到1molNaOH,在阳极反应的离子就得到1mol电子
(D)标准状况下,1L辛烷完全燃烧后所生成气态产物的分子数为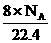
高考重要考点二:氧化还原反应(包括氧化还原反应的基本概念;氧化性还原性强弱的判断;
根据得失电子守恒推断氧化产物或还原产物;配平氧化还原反应的方程式并标出电子转移的
方向和数目)
3、下列有关阿伏加德罗常数的叙述正确的是( BC )
(A)1mol Na2O2与足量水蒸气反应转移电子数为2×6.02×1023个
(B)1mol碳酸钠溶于水所得溶液中所含阴离子数大于0.1×6.02×1023个
(C)25℃时,1g水中约含有6.02×1013个OH-
(D)1molSiO2晶体中约含2×6.02×1023个Si-O键
2、下列有关阿伏加德罗常数的叙述正确的是( BC )
(A)17g OH-含有9×6.02×1023个电子
(B)标准状况下,0.5×6.02×1023个甲醛分子所占体积约是11.2L
(C)106g碳酸钠固体中含有6.02×1023个阴离子
(D)标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2
1、NA代表阿伏加德罗常数值,下列说法正确的是( D )
(A)9g重水所含有的电子数为5NA
(B)1molMgCl2中含有离子数为NA
(C)7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
(D)1molC10H22分子中共价键总数为31NA
23、将a g含NaOH样品溶解在b mL 0.1 mol/L的硫酸中,再加入c mL 0.1 mol/L的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是(NaOH式量为40)
A.[(b-c)/125a]× 100% B.[(b-2c)/125a]×100%
C.[(b-c)/250a]× 100% D.[(8b-8c)/a]× 100%
22、甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是
(A)XY (B)X2Y (C)X2Y3 (D)X2Y5
21、分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水)。下列关于甲、乙溶解度的叙述中肯定正确的是( )
A. 20℃时,乙的溶解度比甲的大 B. 20℃时,甲的溶解度比乙的大
C. 温度对乙的溶解度影响较大 D. 温度对甲的溶解度影响较大
20、已知某盐在不同温度下的溶解度(见下表):
|
T(℃) |
0 |
10 |
20 |
30 |
40 |
|
S(g / 100 g水) |
11.5 |
15.1 |
19.4 |
24.4 |
37.6 |
若把质量分数为22%的该盐溶液由60℃逐渐冷却,则开始析出晶体的温度应在( )
A. 0℃-10℃ B. 10℃-20℃ C. 20℃-30℃ D. 30℃-40℃
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com