
题目列表(包括答案和解析)
46、将pH=2的盐酸和pH=12的氨水等体积混合后,溶液中浓度关系正确的是( C )
(A)c(NH4+)> c (Cl-)> c (H+)> c (OH-) (B)c (Cl-)> c (NH4+)> c (OH-)> c (H+)
(C)c (NH4+)> c (Cl-)> c (OH-)> c (H+) (D)c (Cl-)> c (NH4+)> c (H+)> c (OH-)
高考重要考点十二:电化学部分
常见题型:①原电池的基本原理;②原电池正负极的判断;③设计原电池,实现某一给定的反应;④原电池电极反应式的书写;⑤电极反应产物的计算(可能会结合生活中的电池或一些新型电池对2、3、4点内容加以考查)
45、将0.2 mol·L-1HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是( BD )
(A)c(HCN)< c(CN-) (B)c(Na+)>c(CN-)
(C)c(HCN)- c(CN-)= c(OH-) (D)c(HCN)+ c(CN-)=0.1mol·L-1
44、已知一种[H+]=1×10-3mol/L的酸和一种[OH-] = 1×10-3mol/ L的碱溶液等体积混合后溶液呈酸性,其原因可能是( B )
(A)浓的强酸和稀的强碱溶液反应 (B)浓的弱酸和稀的强碱溶液反应
(C)等浓度的强酸与弱碱溶液反应 (D)生成了一种强酸弱碱盐
43、将0.1mol下列物质置于1L水中充分搅拌,溶液中阴离子数最多的是( C )
(A)KCl (B)Mg(OH)2 (C)Na2CO3 (D)MgSO4
42、重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD= -lg[D+],以下关于pD的叙述正确的是( CD )
(A)中性溶液的pD=7.0
(B)含0.01mol NaOD的D2O溶液1L,其pD=12.0
(C)溶解0.01molDCl的D2O溶液1L,其pD=2.0
(D)在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,其pD=1.0
高考重要考点十一:盐类的水解及离子浓度大小的比较
41、在0.01mol/L硫酸溶液中,水电离出的H+浓度是( D )
(A)1×10-12mol/L (B)0.02mol/L (C)1×10-7mol/L (D)5×10-13mol/L
40、pH相同的盐酸和醋酸溶液分别和锌反应,若最后锌都已完全溶解,但放出的气体一样多,则下列判断正确的是( AC )
(A)整个反应阶段平均反应速率:醋酸>盐酸
(B)反应所需时间:醋酸>盐酸
(C)参加反应的锌的质量:醋酸=盐酸
(D)开始反应速率:盐酸>醋酸
高考重要考点十:水的电离和溶液的pH的简单计算
39、 在10℃和200KPa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出不同压强下反应建立平衡时物质D的浓度:
在10℃和200KPa的条件下,反应aA(g) dD(g)+eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出不同压强下反应建立平衡时物质D的浓度:
|
压强/ Pa |
200KPa |
500KPa |
1000KPa |
|
D的浓度/mol·L-1 |
0.085 |
0.20 |
0.44 |
根据表中数据,回答下列问题:
(1)压强从200KPa增大到500KPa时,平衡向 反应方向移动(填“正”或“逆”),其理由是 。
(2)压强从500KPa增加到1000KPa,平衡向 反应方向移动(填“正”或“逆”),其理由是 。平衡之所以向该方向移动,这是由于 。
答案:(1)平衡向逆反应方向移动,理由是D浓度增大的倍数(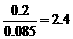 ),小于压强增大的倍数(
),小于压强增大的倍数(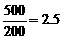 ),平衡之所以向该方向移动,是由于压强的增大,产物之一可能转化为固体或液体物质。
),平衡之所以向该方向移动,是由于压强的增大,产物之一可能转化为固体或液体物质。
(2)平衡向正反应方向移动,理由是D浓度增大的倍数(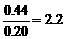 ),小于压强增大的倍数(
),小于压强增大的倍数(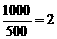 )
)
高考重要考点九:弱电解质的电离平衡
38、 在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( A )
在一恒定的容器中充入2 mol A和1 mol B发生反应:2A(g)+B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为( A )
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
37、 右图表示可逆反应A(g)+B(g)
nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( BC )
右图表示可逆反应A(g)+B(g)
nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( BC )
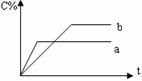 (A)a表示有催化剂,而b无催化剂
(A)a表示有催化剂,而b无催化剂
(B)若其他条件相同,a比b的温度高
(C)若其他条件相同,a比b的压强大,n>2
(D)反应由逆反应方向开始
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com