
题目列表(包括答案和解析)
19、科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子,关于该元素的下列叙述正确的是( BD)
(A)其原子核内中子数和质子数都是112
(B)其原子核内中子数为165,核外电子数为112
(C)其原子质量是12C原子质量的277倍
(D)其原子质量与12C原子质量之比为277∶12
18、已知元素X、Y的核电荷数分别是a和b,它们的离子X m+ 和Y n-的核外电子排布相同,则下列关系式中正确的是( A )
(A)a=b+m+n (B)a=b-m+n (C)a=b+m-n (D)a=b-m-n
17、下列各组离子中,因发生氧化还原反应而不能大量共存的是( D )
(A)Fe3+、H+、SO42-、ClO- (B)Fe3+、Fe2+、SO42-、NO3-
(C)Al3+、Na+、SO42-、CO32- (D)K+ 、H+、Cl-、MnO4-
高考重要考点六:元素周期律 物质结构(包括①原子序数、核电荷数、质子数、中子数、核外电子数及质量数之间的相互关系;②质量数、原子的原子量及元素的原子量的区别与联系;③元素周期表中各主族元素的性质及其递变规律;④微粒半径大小的比较(主要是与原子序数之间的关系);⑤化学键类型和晶体类型的判断;⑥电子式的书写(关键在于掌握书写方法,以能够写出陌生物质的电子式)。
16、某溶液中加入金属铝有氢气放出,则在此溶液中可能大量共存的离子是( C )
(A)K+、Mg2+、NO3-、SO42- (B)K+、Na+、Cl-、HCO3-
(C)K+、Na+、AlO2-、SO42- (D)K+、NH4+、Cl-、CO32-
15、下列离子方程式错误的是
(A)将少量SO2气体通入NaClO溶液中
SO2+2ClO-+H2O==SO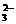 +2HClO
+2HClO
(B)在硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7
2H++SO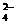 +Ba2++2OH-==BaSO4↓+2H2O
+Ba2++2OH-==BaSO4↓+2H2O
(C)小苏打溶液和甲酸混合
HCO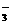 +HCOOH = HCOO-+CO2↑+H2O
+HCOOH = HCOO-+CO2↑+H2O
(D)澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO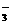 ==CaCO3↓+H2O
==CaCO3↓+H2O
高考重要考点五:判断溶液中的离子能否大量共存
14、下列反应的离子方程式正确的是( D )
(A)金属钠跟水反应:Na+2H2O=Na++2OH-+H2↑
(B)在漂白粉溶液中通入过量SO2 :ClO-+SO2+H2O=HSO3-+HClO
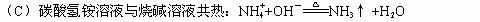
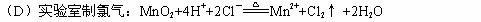
13、下列反应的离子方程式正确的是( B )
(A)碳酸钙跟醋酸溶液反应:CaCO3+2H+=Ca2++2H2O+CO2↑
(B)澄清石灰水跟盐酸反应:H++OH- =H2O
(C)铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
(D)碳酸氢钠溶液与足量的氢氧化钡溶液混合:
Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
12、已知1g氢气燃烧生成液态水放出142.9KJ的热量,则反应的热化学方程式为( B )
(A)2H2(g)+O2(g)=2H2O(l) △H= -142.9KJ/mol
(B)2H2(g)+O2(g)=2H2O(l) △H= -571.6KJ/mol
(C)2H2+O2=2H2O △H= -571.6KJ/mol
(D)2H2(g)+O2(g)=2H2O(l) △H= +571.6KJ/mol
高考重要考点四:离子方程式的书写及正误判断
11、已知31g白磷变成31g红磷放出18.39KJ热量,下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s) △H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s) △H= -Q2 KJ/mol
Q1和Q2的关系为( A )
(A)Q1>Q2 (B)Q1=Q2 (C)Q1<Q2 (D)无法确定
10、相同状况下:H2(g)+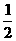 O2(g)=H2O(g) △H= -Q1KJ/mol;
O2(g)=H2O(g) △H= -Q1KJ/mol;
2H2(g)+O2(g)=2H2O(l) △H= -Q2KJ/mol;
则Q1和Q2的关系为( C )
(A)Q1>Q2 (B)Q1=Q2 (C)2Q1<Q2 (D)Q1=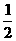 Q2
Q2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com