
题目列表(包括答案和解析)
3.晶体熔、沸点比较
(1)异类晶体:原子晶体(离子晶体)分别大于分子晶体
一般地,原子晶体>离子晶体>分子晶体
(2)同种类型晶体:构成晶体质点间的作用力大,则熔、沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径越小,离子键越强,则熔、沸点越高。
②分子晶体:对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,则熔、沸点越高。
在同分异构体中,一般地,支链越多,熔、沸点越低。
③原子晶体:原子半径越小,键长越短、键能越大,则熔、沸点越高
④金属晶体:金属阳离子半径越小,离子所带的电荷越多,则金属键越强,金属熔、沸点越高
★例题精析
[例1]:下列性质中,可以证明某化合物内一定存在离子键的是:( )
A.可以溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
[例2]:下列化合物中阴离子半径和阳离子半径之比最大的是:
A.LiI B. NaBr C. KCl D. CsF
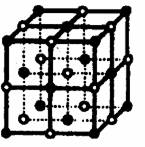 [例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是:
[例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是:
A.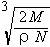 B.
B. 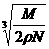
C. 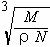 D.
D.
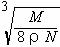
[例4]:根据石墨晶体结构示意图及提供的数据计算(保留三位有效数值)。有关公式、数据见框图。⑴12 g石墨中,正六边形的数目有多少?
⑵求石墨密度。
 ⑶求12克石墨的体积。
⑶求12克石墨的体积。
例1.D 例2 A
例3 分析:品胞中有4个NaCl ,ρ=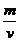 =
= 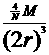 选B
选B
例4、(1)每个六边形平均含碳6×1/3=2,正六边形个数为 ×6.02×1023÷2=3.01×1023 (个)
×6.02×1023÷2=3.01×1023 (个)
(2)每个六棱柱平均含碳原子 6×2×1/6 = 2(个)
ρ= =2.28(g/cm3)
=2.28(g/cm3)
(3)12g石墨的体积为12÷2.28=5.26 (cm3)
2.四种晶体的比较
|
晶体类型 |
离子晶体 |
原子晶体 |
分子晶体 |
金属晶体 |
|
存在粒子 |
|
|
|
|
|
粒子间作用 |
|
|
|
|
|
熔、沸点 |
|
|
|
|
|
硬度 |
|
|
|
|
|
溶解性 |
|
|
|
|
|
导电性 |
|
|
|
|
|
实例 |
|
|
|
|
1.离子键、共价键、金属键的比较
|
|
离子键 |
共价键 |
金属键 |
|
|
极性共价键 |
非极性共健 |
|||
|
成键元素 |
活泼的金属元素 活泼的非金属元素 |
一般是不同的非金属元素之间 |
一般是同种非金属元素之间 |
同种金属元素 |
|
成健粒子 |
阴、阳离子 |
原子 |
原子 |
金属阳离子和自由电子 |
|
粒子间相互作用 |
静电作用 |
共用电子对 |
共用电子对 |
静电作用 |
|
电子式举例 |
|
|
|
|
2.常见几种晶体的结构分析(点、线、面、体)
(1)氯化钠晶体 (2)氯化铯晶体
(3)二氧化碳晶体 (4)白磷分子的结构
(5)Cn的结构 (6)金刚石晶体
(7)二氧化硅晶体 (8) 石墨晶体
★巧思巧解
1. 几个基概念
化学键:相邻的两个或多个原子间强烈的相互作用
共价键:原子间通过共用电子对所形成的相互作用
离子键:阴、阳离子通过静电作用所形成的化学键
极性键:由不同元素的原子所形成的共价键
非极性键:由相同元素的原子所形成的共价键
金属键:金属阳离子与自由电子之间较强烈的作用叫金属键。
氢键:
范德华力(分子间作用力)
极性分子 非极性分子
离子晶体 分子晶体
原子晶体 金属晶体
15、
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可反氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可反氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
14、A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。
五种元素两两形成的化合物有甲、乙、两、丁四种,分子中原子个数比如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元 素原子个比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
(1)写出元素符号:B E
(2)A元素某原子核内中子数比质子数多1,则该核素的核组成符号为 。
物质丁的分子为 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是 。
(4)已知有机物乙的分子为平面结构,碳氢键间的夹角约为120°,实验室制取乙的化学方程式为 。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为 。
13、已知X、Y、Z、W四钟元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为 。
(2)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 。
12、短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是 、 、 、 。
(2)画出C―和D原子的结构示意图
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为________________,写出有关离子方程式_______________________;__________________。
11、甲、乙、丙为短周期内的三种元素。乙、甲依次位于周期表中同周期的相邻主族,乙元素的族序数为丙元素的2倍。甲、乙、丙原子的价电子数之和为11,电子层数之和为7。试回答:(1)三元素的名称是:甲___________,乙___________,丙_________。
(2)丙元素单质与乙元素最高氧化物发生反应的化学方程式是:______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com