
题目列表(包括答案和解析)
3.含有元素硒(Se)的保健品现在已开始进入市场,下列关于硒的叙述错误的是
A. 最高价氧化物的化学式为SeO3 B. 原子序数为24
C. 气态氢化物的化学式为H2Se D. 非金属性比溴弱
2.元素X的气态氢化物的分子式为H2X,这种元素的最高价氧化物的水化物的化学式可能是
A. H2XO3 B. X(OH)2 C. H2XO4 D. H6XO6
1.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A. 饱和碳酸钠溶液 B. 高锰酸钾溶液
C. 石灰水 D. 饱和碳酸氢钠溶液
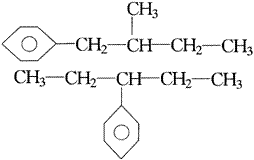
故本题的正确选项为B。 例2.某化合物的分子式为C10H13Cl,分析数据表明,分子中有两个-CH3、一个-CH2-、
一个
,一个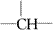
,一个-Cl,
它可能的异构体为:_________。
解析:用上述方法可知题给“基”中,端基为:两个-CH3、一个-Cl;非端基为:
一个-CH2-、一个 、
、
一个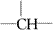 ,
,
显然非端基构建的异构体有三种:
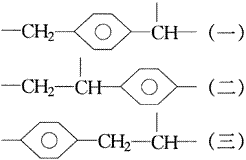
把端基插入(一)可得两种异构体,分别是:
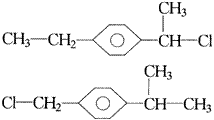
把端基插入(二)可得三种异构体,分别是:
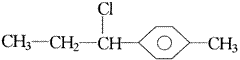
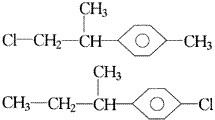
把端基插入(三)也可得到两种异构体,分别是:
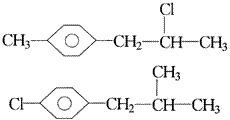
遇到问题时,要勤于动脑,善于动手,把“难题”拆分、归类、重组、深入探索、研究,问题便会得到解决。
3、再由细节,求完善
⑴为了使沉淀完全,沉淀剂必须过量;过量的试剂必须准确测出,涉及的实验步骤要尽可能少。
⑵中和滴定中指示剂的选择也很关键。仅仅从中和反应本身来讲,甲基橙、酚酞皆可用,但在此实验中影响到实验操作的难易。如选甲基橙作滴定过量碱的指示剂,就必须对生成的Mg(OH)2沉淀进行过滤、洗涤且将洗涤液合并后,再进行滴定;如选酚酞试液作指示剂,Mg(OH)2沉淀就无需过滤,因为酚酞变色范围在pH=8~10,滴定到终点时Mg(OH)2沉淀不会溶解。显然,用酚酞作指示剂简化了实验步骤,提高了实验的精确度,所以应选用酚酞作为测定过量的NaOH 的指示剂。
综合1、2、3的分析具体解答如下:
(第一步题中已定)
第二步:加入A mL a mol·L-1NaOH溶液(过量),充分反应;
第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴
第四步:用c mol·L-1HCl溶液滴定至由浅红色为无色止。消耗HCl 溶液B mL
KCl·MgCl2·6H2O% 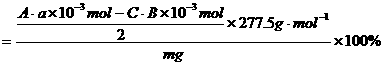
2、由实验操作的难易确定最佳途径
①测定沉淀的质量:需要过滤、洗涤、烘干,步骤多误差较大
②测定所加试剂的量:可通过滴定法,精确度较高,操作较简便。
由此可见,方法②为最佳途径。
第一步:称取mg 样品,放入250ml烧杯中,加适量水溶解
第二步:……
计算样品中含KCl·MgCl2·6H2O(式量为277.5)的质量分数表达式:_________________
命题意图:本题原是已知具体实验步骤,要求学生按照实验所得数据求样品的质量分数,现在命题者将原实验题的实验步骤拆掉一部分,从而造成实验途径多样性,要求学生根据实验要求及具体细节来确定实验最佳途径。因此,本题以光卤石样品中KCl·MgCl2·6H2O的质量分数测定为题设情景,通过设置的多重性实验途径和具体细节,让学生完成光卤石样品的质量分数所需的实验步骤和质量分数表达式。考查学生思维广阔性、周密性、深刻性及批判性。
解题思路:
1、 由条件找关系
可能的离子反应:
①Mg2++2OH-=M(OH)2↓ ②Mg2++CO32-=MgCO3↓ ③Ag++Cl-=AgCl↓
分别与KCl·MgCl2·6H2O可能构成的关系式有:
2OH -→Mg2+→M(OH)2→KCl·MgCl2·6H2O
CO32-→Mg2+→MgCO3↓→KCl·MgCl2·6H2O
Ag+→Cl-→AgCl↓→1/3KCl·MgCl2·6H2O
由上述关系可见,求KCl·MgCl2·6H2O的量,可从所加试剂的量入手,也可用生成沉淀的质量的进行计算来求得。
(1)a mol·L-1NaOH溶液 (2)b mol·L-1Na2CO3溶液 (3)c mol·L-1HCl溶液
(4)d mol·L-1AgNO3溶液 (5)酚酞试液 (6)甲基橙试液
31.(04上海)黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为
|
(2)已知 2CuFeS2 + 4O2 ───→ Cu2S + 3SO2 + 2FeO (炉渣)
产物Cu2S在1200℃高温下班继续反应:
2Cu2S + 3 O2 → 2Cu2O + 2 SO2
2 Cu2O + Cu2S → 6Cu + SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜
26.(12分)
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且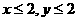 )
)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: ;石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO23.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定
该混合物中孔雀石和石青的物质的量之比。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com