
题目列表(包括答案和解析)
26.取一定物质的量浓度的NaOH溶液100 mL,然后向其通入一定量的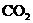 气体,得到溶液A,向A中逐滴缓慢加入0.1 mol·
气体,得到溶液A,向A中逐滴缓慢加入0.1 mol·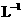 的HCl溶液,产生的
的HCl溶液,产生的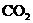 气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
(1)A溶液中的溶质为(化学式)________,其物质的量之比是________.
(2)通入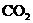 气体体积(标准状况)________.
气体体积(标准状况)________.
(3)NaOH溶液的物质的量浓度________.
25.现有分子式均为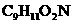 的A、B两种有机物,光谱测定显示A的分子结构中不含甲基,B分子结构中含有1个甲基;A、B分子结构中都含有苯环.
的A、B两种有机物,光谱测定显示A的分子结构中不含甲基,B分子结构中含有1个甲基;A、B分子结构中都含有苯环.
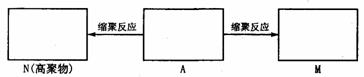
(1)有机物A是天然蛋白质的水解产物,一定条件下,两个A分子发生缩合反应生成M;A分子间还可以通过缩聚反应得到N.
①请将A、M和N的结构简式填入相应的方框中.
②已知氨基酸在水中存在如下平衡:


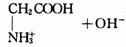 现有A的水溶液,若向其中加入盐酸,则平衡向________方向移动;有机物________(结构式)的浓度增大.向A中加入NaOH溶液,则平衡向________方向移动;有机物________(结构式)的浓度增大.
现有A的水溶液,若向其中加入盐酸,则平衡向________方向移动;有机物________(结构式)的浓度增大.向A中加入NaOH溶液,则平衡向________方向移动;有机物________(结构式)的浓度增大.
(2)化合物B是硝基苯的同系物,写出化合物B所有可能的结构简式:_______________.
24.(8分)某化学反应2A(l) B(l)+D(l)在四种不同情况下进行,B、D的起始浓度为零,反应物A的浓度(mol·
B(l)+D(l)在四种不同情况下进行,B、D的起始浓度为零,反应物A的浓度(mol·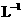 )随时间(min)变化情况如下表:
)随时间(min)变化情况如下表:
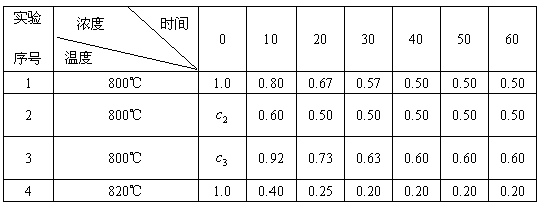
根据上述数据,完成下列填空:
(1)在实验1中,反应在10-20 min时间内A的平均速率为________mol/(L·min)
(2)在实验2中,A的初始浓度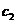 =________mol·
=________mol·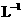 ;反应经20 min就达到平衡,可推测实验2中还隐含的条件是________,理由是________.
;反应经20 min就达到平衡,可推测实验2中还隐含的条件是________,理由是________.
(3)由起始到平衡时,设实验3中A的平均反应速率为 ,实验1中A的平均反应速率为
,实验1中A的平均反应速率为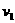 ,则
,则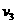 ________
________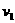
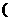 填“>”、“=”或“<”
填“>”、“=”或“<”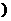 且
且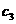 ________1.0 mol·
________1.0 mol·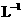
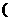 填“>”、“=”或“<”
填“>”、“=”或“<”
(4)比较实验4和实验1,可推测该反应的正反应是________反应(填“吸热”“放热”)理由是________________________________________________________________________.
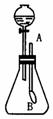
23.(5分)如下图所示,在250 mL的锥形瓶中,充满某种无色、有刺激性气味的气体,分液漏斗中装有NaOH溶液,导管的A端通大气、B端捆有一小气球.在标准状况下实验:开启分液漏斗活塞,滴加NaOH溶液,气球逐渐胀大,当滴加NaOH溶液共10 mL时,恰好反应完全,且锥形瓶中的溶液恰好呈中性.则原锥形瓶中装有的气体是(填名称)_____________;气球逐渐胀大的原因是_____________,分液漏斗中的NaOH溶液物质的量浓度不超过_____________(保留2位小数).
22.(6分)(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后溶液呈________(填“酸性”“碱性”“中性”),其原因用离子方程式表示是_____________.
(2)已知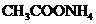 溶液为中性,又知
溶液为中性,又知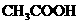 加入
加入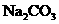 溶液中有气体放出,试推断
溶液中有气体放出,试推断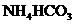 溶液的pH________7(填“大于”“小于”或“等于”);将同温度下等浓度的三种盐溶液:
溶液的pH________7(填“大于”“小于”或“等于”);将同温度下等浓度的三种盐溶液:
A.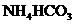 B.
B.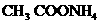 C.
C.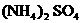
按pH由大到小的顺序排列________(填序号).
21.(15分)请按要求回答下列问题:
(1)请分别指出中学所学常见的强酸和强碱(各不少于3种)
强酸:________________________________________________.
强碱:________________________________________________.
(2)请指出中学所学常见的强氧化剂,其中属于单质的有________(不少于3种);属于化合物的有________________________(不少于4种).
(3)认识物质化学性质的方法一般可以利用酸、碱、盐氧化物之间的反应规律,氧化还原反应的概念,物质的结构,元素周期律等,以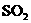 为例.
为例.
A.依据酸、碱、盐、氧化物之间的反应规律分析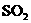 具有的化学性质(要求写出有关化学方程式)
具有的化学性质(要求写出有关化学方程式)
①能与碱反应: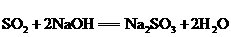 ,
,
②________________________________________________,
③________________________________________________,
④________________________________________________.
B.依据氧化还原反应的概念分析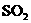 具有的化学性质(写化学方程式)
具有的化学性质(写化学方程式)
①________________________________________________,
②________________________________________________.
(4)请观察分析下列各组物质,指出各组物质具有的共同化学性质,每组各举一例,用化学方程式或离子方程式说明:
①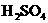 ,
,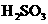 ,
,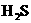 ,
,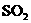 ,
,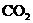 ,
,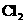 ,
,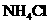 ,
,
共性________________;举例________________.
②NaOH,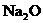 ,CaO,Na,Fe,
,CaO,Na,Fe,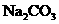 ,
,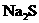 ,
,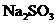
共性________________;举例________________.
③Al,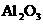 ,
,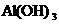 ,
, ,
, ,NaHS,
,NaHS,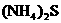
共性________________;举例________________.
20.单质钛的机械强度高,抗蚀能力强,有“未来金属”之称,工业上常用硫酸分解钛铁矿( )的方法制取
)的方法制取 ,再由
,再由 制金属钛,主要反应有( )
制金属钛,主要反应有( )
①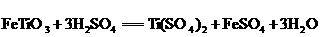
②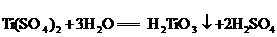
③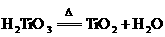
④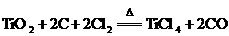
⑤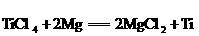
下列叙述错误的是( )
A.反应①是非氧化还原反应
B.反应②是水解反应
C.反应④中 是氧化剂
是氧化剂
D.反应⑤是置换反应
第Ⅱ卷(非选择题 共60分)
19.中草药秦皮中含有的七叶树内酯具有抗菌作用,其结构为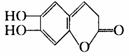 ,下列有关叙述不正确的是( )
,下列有关叙述不正确的是( )
A.能与浓溴水发生取代反应
B.能与浓溴水发生加成反应
C.能使高锰酸钾酸性溶液褪色
D.1 mol该物质最多能与2 mol NaOH反应
18.生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜之间可构成微型的生物原电池,上述判断正确的是( )
①正极电极反应可能是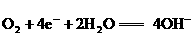
②负极电极反应可能是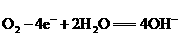
③负极的反应主要是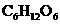 (葡萄糖)生成
(葡萄糖)生成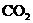 或
或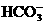
④正极的反应主要是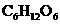 生成
生成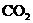 或
或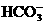
A.①② B.①③
C.②④ D.②③
17.A、B两固体的溶解度都随温度升高而增大.现将80℃时A和B的饱和溶液各100 g降温到20℃,A晶体析出的量比B晶体析出的量多(均不含结晶水),下列说法正确的是( )
A.80℃时A的溶解度一定大于B的溶解度
B.20℃时A的溶解度一定小于B的溶解度
C.在20℃-80℃温度范围内,A和B的溶解度曲线一定相交
D.在20℃-80℃温度范围内,温度对A溶解度影响一定比B大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com