
题目列表(包括答案和解析)
5.下列操作正确的是 ( )
A.把pH试纸浸入溶液中测定溶液的pH
B.称量NaOH固体时,把NaOH固体放在有滤纸的托盘上称量
C.苯酚沾在皮肤上立即用酒精擦洗
D.用水清洗做过碘升华实验的试管
4.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是( )
A.C(s)+H2O(g)= CO(g)+H2(g);△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(l)+8H2O (l);△H>0
C.CaC2(s)+2H2O(l)→Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)→ CO2(g)+2 H2O (l);△H<0
3.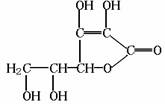 维生素C可用于预防和治疗坏血病等,其结构式如右下图所示。下列关于维生素C的叙述错误的是( )
维生素C可用于预防和治疗坏血病等,其结构式如右下图所示。下列关于维生素C的叙述错误的是( )
A.维生素C的化学式为C6H8O6
B.维生素C可作食品添加剂
C.维生素C可发生水解反应
D.维生素C不能发生氧化反应
2.目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。下列说法正确的是( )
A.它是由两种单质组成的混合物 B.它是一种硅酸盐
C.它是一种新型化合物 D.它是一种高聚物
1.下列关于“生活中的化学”的叙述中不正确的是 ( )
A.棉花和蚕丝的主要成分都是纤维素
B.误食重金属盐,立即喝牛奶或生蛋清进行解毒
C.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
D.新居室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染室内空气
26.(12分)一定温度下,向一固定容积的密闭容器中加入2 mol A和1 mol B,发生下述反应:2A(g)+B(g) 3C(g)+D(s);ΔH<0。达到平衡时生成了1.2
mol C。
3C(g)+D(s);ΔH<0。达到平衡时生成了1.2
mol C。
(1)在相同条件下,若向该容器中改为加入1 mol A、0.5mol B,要使平衡混合气体中各物质的百分含量与原平衡的相同,在D足量时,则还应加入________mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.2 mol 。则D的起始物质的量n(D)应满足的条件是:
_ _________ ____。
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是
______________ ______________;
A、B、C、D四种物质相对分子质量之间的关系为___ _________ ______
(用MA、MB、MC、MD表示)。
(4)若将容器改为容积可变的容器,在相同温度下,压强为P0时,建立上述平衡之后,A的浓度为M mol/L。持续增大压强,当压强为3 P0时,A的平衡浓度为M1 mol/L;当压强为30 P0时,A的平衡浓度为M2 mol/L;当压强为300 P0时,A的平衡浓度为M3 mol/L。测得M1=3M,M2>30M,M3<300M。试解释形成这种结果的可能的原因:
①3 P0时:________________ ________,
②30 P0时:__________________ _____,
③300 P0时:__________________ ____。
25.(8分)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体的晶格能的是 。
A.Na+(g)+Cl-(g) NaCl(s);
△H B.Na(s)+1/2Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2 D.Na(g)-e- Na+(g); △H3
E.1/2Cl2(g) Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式
。
氧化亚铁晶体结构与氯化钠晶体结构相似,则:
(3)氧化亚铁晶体中,跟二价铁离子紧邻且等距的二价铁离子个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为 ,则氧化亚铁晶体中二价铁离子与氧离子之间最近距离是
cm(用代数式表示)
,则氧化亚铁晶体中二价铁离子与氧离子之间最近距离是
cm(用代数式表示)
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将______ (填“减少”、“增多”或“保持不变”)。
24.(10分)已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
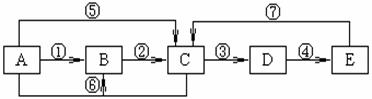
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。由此可知:E的化学式为 。
当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目,即G和CO2互称为等电子体)和一种无色无味的液体H,写出F分解生成G+H的化学方程式 _____ 。
(2)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,D被冰水冷却时变成无色晶体,此无色晶体的化学式是 。根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物形式均可)。
23.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是______________________,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
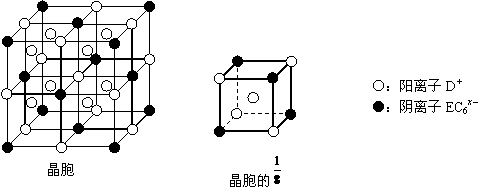
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。
该化合物的化学式是____ _____。
22.(8分)现有浓度均为0.10mol/L的五种电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是 (填编号)
(2)将五种溶液稀释相同倍数时,其pH变化最大的是 (填编号)
(3)各取上述五种溶液25.00mL,分别滴加入0.10mol/L、25.00mL的HCl溶液,所得溶液pH最大的是 (填编号)。
实验中,量取25.00mLNaAlO2溶液可用 。
(4)将上述①②③④四种溶液两两混合,有一对溶液相互间能发生反应,写出该反应的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com