
题目列表(包括答案和解析)
2.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是 ( )
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第IIIA族的元素 D.B是第3周期IVA族的元素
1.以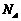 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A 0.1 mol H3O+中含有 个电子 B标准状况下,11.2L臭氧中含有
个电子 B标准状况下,11.2L臭氧中含有 个氧原子
个氧原子
C 2g重氧水(H218O)含有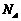 个中子 D 84gNaHC03晶体中含有
个中子 D 84gNaHC03晶体中含有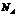 个CO32-
个CO32-
37.已知反应BeCl2+Na2BeO2+2H2O==2NaCl+2Be(OH)2能完全进行,则下列推断中,正确的是
A. BeCl2溶液的pH<7,将其蒸干并灼烧后,得到残留物可能为BeO
B. Na2BeO2溶液的pH>7,将其蒸干并灼烧后,得到残留物可能为BeO
C. Be(OH)2只能溶于盐酸不能溶于烧碱溶液
D. BeCl2水溶液的导电性强,因此BeCl2一定是离子化合物
36.(1)将标准状况下11.2L的NH3气体溶于100mL水中,得到密度为0.868g·cm-3的氨水。求所得氨水的物质的量浓度是多少?
(2)将上述氨水30mL与70mL2mol· L-1的AlCl3溶液相混合,生成a克沉淀,则a的数值为多少?
(3)往上述(2)反应后未过滤的浊液中加入VmL5mol· L-1 的NaOH溶液后。沉淀物的质量仍为a克,则V的取值为多少?
35.a mol 铁和bmol硫磺在隔绝空气条件下加热,使两者充分反应,然后
将反应混合物与足量的稀硫酸溶液在适当的条件下反应,通过计算回答:
(1)生成的气体在标准状况下的体积(L)为多少?
(2)生成的气体在标准状况下的密度ρ(g/L)的取值范围(用分式表示)是多少?
(3)若生成的气体不少于b mol时,则a、b的关系是什么?
(4)当a+b=1时,欲使产生的气体的密度为最大值,则a、b的取值范围各为多少?
34.有一批PbO和PbO2的混合物样品,用高锰酸钾法测定其含量。称取该样品加入20.00ml 0.2500mol·L-1草酸溶液,将PbO2还原为Pb2+,然后用氨水中和溶液,使全部Pb2+形成PbC2O4沉淀,化学方程式为:
PbO2 + 4H+ + C2O42-== Pb2+ +2H2O + CO2↑
Pb2+ + H2C2O4 + 2NH3·H2O == PbC2O4↓+ 2NH4+ + 2H2O
过滤后将滤液酸化,用标准KMnO4溶液滴定,共用0.04mol·L-1KMnO4溶液10.00ml;沉淀溶解于酸中再用同浓度的KMnO4标准溶液滴定,用去了30.00ml,化学方程式为:
2MnO4- + 5C2O42-+ 16H+ == 2Mn2+ + 10CO2↑+ 8H2O
计算试样中PbO和PbO2的质量分数(摩尔质量:PbO2-239g/mol,PbO-223g/mol)
33.某结晶水合物,含有两种阳离子和一种阴离子,其中所含元素均为短周期元素。为确定其
组成,有同学进行了如下实验:
称取9.06 g样品,溶于水,将溶液分成两等份,待用。
①向一份溶液中逐滴加入6mol·L-1 NaOH溶液,先观察到有白色沉淀产生,而后产生使湿润的红色石蕊试纸变蓝色的气体,继续滴加NaOH,白色沉淀又逐渐消失,最后得到无色透明溶液。向其中加入足量BaCl2溶液,可得不溶于稀盐酸的白色沉淀4.66 g。
②取另一份溶液,加入足量6mol· L-1NaOH溶液,加热,收集到标准状况下的气体224 mL。然后,往溶液中通入足量CO2,过滤,将所得沉淀洗涤、烘干、灼烧,得白色固体0.51 g。
请回答:
(1)该结晶水合物中含有的两种阳离子是 、 ;一种阴离子是 。
(2)试通过计算确定该结晶水合物的化学式,请写出计算过程。
32. 按下图所示步骤以不饱和烃A为原料合成
:
按下图所示步骤以不饱和烃A为原料合成
:
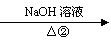

A(CH2=CH-CH=CH2) B C
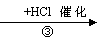
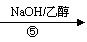
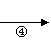
 F
G
F
G
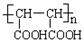
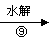
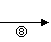


H I J[(C4H2O3)n]
已知:
①CH2=CH-CH=CH2和Br2按1:1反应,生成CH2Br-CHBr-CH=CH2或
 CH2Br-CH=CH-CH2Br ;
CH2Br-CH=CH-CH2Br ;
 ②
②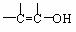 (不稳定)
;
(不稳定)
;


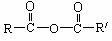
 ③
③
+ + H2O
(1)写出结构简式:B ,F 。
(2)①~⑨中属于加成反应的有 (填序号)。
(3)写出②、⑤、⑧步的化学方程式:
②
⑤
⑧
(4)在上述合成路线中,有人提议略去③④⑤⑥,由C直接制H,是否合理 ,
理由是 。
 (5)在上述合成路线中,又有人提议由H直接制
,是否合理
,
(5)在上述合成路线中,又有人提议由H直接制
,是否合理
,
理由是 。
31.有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,试回答:
⑴若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
⑵若A有四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
⑶若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
30.将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
|
温度/℃ |
25 |
300 |
350 |
400 |
500 |
600 |
900 |
|
固体质量/g |
1.000 |
0.800 |
0.800 |
0.400 |
0.444 |
0.444 |
0.429 |
根据计算分析推理,完成下列填空:
(1)写出25℃~300℃时固体发生变化的化学方程式______________________________,
判断理由是_______________________________________________________。
(2)250℃~400℃时发生变化得到的产物是_______________________________________,
物质的量之比为___________________________。
(3)500℃时产物的含氧质量分数为_____________________________。
(4)写出600℃~900℃时发生变化的化学方程式_____________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com