
题目列表(包括答案和解析)
2.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
1.人的血液总是维持在PH=7.37-7.45范围内,这是由于
A.人体中有大量水分(占体重70%)
B.血液中氯化钠保持一定浓度
C.排出的二氧化碳溶解在血液中
D.血液中HCO3-和H2CO3的浓度稳定在一定范围内
20.(12分)(1)如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液中由水电离出的c(H+)_____________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):


(2)在含有A-、Na+、H+、OH-的水溶液中,如果出现下列关系,请将它们在溶液中可能对应的溶质分别填入横线上。
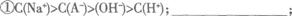

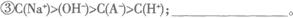
19.(12分)某校研究性学习小组设计实验测定电石样品的纯度。
经查阅有关资料得知:H2S、PH3与硫酸铜溶液反应的化学方程式分别是
H2S+CuSO4==CuS↓+H2SO4 ;19PH3+56CuSO4+44H2O==11H3PO4+56H2SO4+32Cu↓+8Cu3P↓。
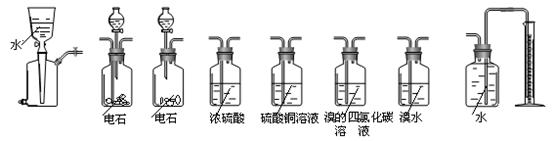 相关仪器和药品装置图如下:
相关仪器和药品装置图如下:
A B C D E F G H
请你参与活动并就下列问题发表你的见解:
⑴按气体从左到右的流向选择合理的装置组合是(选填字母序号):
⑵经小组同学讨论认为乙炔的吸收装置选用F装置最佳。理由是:
⑶为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是 。
⑷若电石样品的质量为m1 g,F吸收乙炔前后的质量差为m2 g,则电石样品中CaC2质量分数ω(CaC2)= 。
18.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学
键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198KJ·mol-1、P-O 360kJ·mol-1、氧气分子内氧原子间的键能为
 498kJ·mol-1则P4+3O2==P4O6的反应热△H为
498kJ·mol-1则P4+3O2==P4O6的反应热△H为
A.+1638 kJ·mol-1 B.一1638 kJ·mol-1
C.一126 kJ·mol-1 D.十126 kJ·mol-1
17.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
16.与醛基相邻的碳原子上的氢原子叫a-H,无a-H的醛在强碱作用下,发生分子间氧化-还原反应生成酸和醇,叫做康尼查罗反应,例如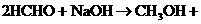
 ,则下列化合物中不发生康尼查罗反应的是( )
,则下列化合物中不发生康尼查罗反应的是( )
① ②
②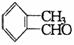 ③
③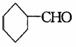 ④
④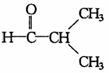
A.①② B.①②④ C.③④ D.①②③④
15.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是 ( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
14.酸碱中和反应属于放热反应,酸碱中和生成1mol水时所放出的热量称为中和热。放下列浓度均为0.1mol/L的溶液混合时,相关说法中正确的是
A.与NaOH反应时,HCL的中和热小于CH3COOH的中和热
B.与NaOH反应时,HCL的中和热大于CH3COOH的中和热
C.与NaOH反应时,H2SO4的中和热大于HCL的中和热
D.与H2SO4反应时,Ba(OH)2的中和热等于NaOH的中和热的2倍
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com