
题目列表(包括答案和解析)
24.(10分)吡咯 的性质与苯酚相似,N原子使邻位氢原子
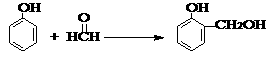 反应活性增强。已知1mol苯酚与1mol甲醛反应如下:
反应活性增强。已知1mol苯酚与1mol甲醛反应如下:
(1)吡咯和甲醛在一定条件下反应生成导电性能优良的高聚物,请写出以它们为原料合成该高聚物的化学方程式:
(2)吡咯在有机溶剂中跟甲醛反应首先可能生成化合物M(分子式为C5H7ON)然后生成少量的化合物N(分子式为C15H15N3)则M、N的结构简式分别为:M N
(3)某有机物化学式为C9H8O2经测定分子中含有苯环,并具有下列性质:①能与NaOH溶液发生中和反应②能与乙醇发生酯化反应③能使溴水褪色。写出该有机物可能的结构简式(苯环上含有两个取代基的有机物只要求写一种)
23. (12分)已知:D.E.F.K.L为气体,E能使澄清石灰水变浑浊,I是金属,1molA在反应①中转移的电子的物质的量为1mol,B.H是常见的化肥,它们有如下图所示转化关系(部分反应中生成的水已略去):试回答下列:
(1) 写出化学式;C_______ D ________ H ______ N ________
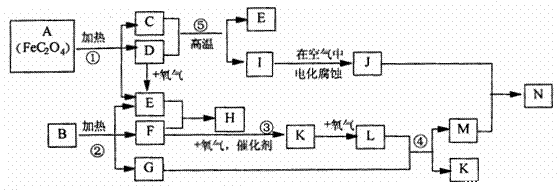 (2)写出反应方程式②____________
③
_____________④
_________
(2)写出反应方程式②____________
③
_____________④
_________
(3)写出离子反应方程式 I+M-N+K:___________________
22.(8分)25℃时,将a mol CH3COOH和b mol NaOH溶于水,形成1L混合溶液。
(1) 该溶液中存在的平衡体系有:
(2)混合溶液的pH (填编号)
①大于7 ②小于7 ③等于7 ④无法确定
(3)若混合溶液中c(Na+)=c(CH3COO-),则混合溶液的pH是
其原因是
|
|
|
①O2 ②H2 ③Cl2 ④CO2 ⑤HCl ⑥NO ⑦H2S
21.(16分)“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述两个实验均为“套管实验”,请观察图31-6的实验装置、分析实验原理,回答下列问题:
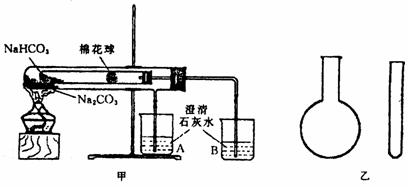 图31-6
图31-6
实验一:如图甲,小试管内塞有沾有无水硫酸铜粉末的棉花球.
(1)从点燃酒精灯开始,棉花球及烧杯A、B中能观察到的现象有_________________
(2)整个实验结束时,在操作上需要特别注意的问题是___________
(3)通过该实验可以得出的结论是
实验二:在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦.请设计一个简单的操作方法,只用一支试管(如图乙),选用下列药品:A.氯化铵固体;B.氢氧化钠固体;C.浓氨水;D.浓硫酸;E.湿润的红色石蕊试纸,采用“套管法”在圆底烧瓶中集满喷泉实验所用氨气.
(4)所用的试剂为:_________________________.(填序号)
(5)请简述所设计的操作及判定收集满氨气的现象:____________
(6)产生氨气的化学反应方程式为:
(7)将上述两个实验与普通实验相比较,“套管实验”明显具备的优点是:
19.下列关于胶体的认识错误的是
A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于化学变化
B.将一束强光通过淀粉溶液,也能产生丁达尔现象
C.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
D.纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9m ),因此纳米材料属于胶体
第Ⅱ卷(共82分)
18.已知95%(溶质的质量分数)酒精溶液的物质的量浓度为16.52mol/L,试判断47.5%酒精溶液的物质的量浓度为
A.大于8.26mol/L B.等于8.26mol/L
C.小于8.26mol/L D.无法判断
17.下列说法正确的是
A.强碱与弱酸所生成的盐,其水溶液一定呈碱性
B.离子晶体中可能含有共价键,分子晶体中不一定含有共价键
C.一切四面体空间构型的分子内键角均为109°28′
D.金属氧化物一定是碱性氧化物
16.已知热化学反应方程式:
2H2(气)+O2(气)=2H2O(液);ΔH=-571.6KJ,
2H2O(气)=2H2(气)+O2(气);ΔH=+483.6KJ。
则下列说法正确的是
A.每摩尔水气化时所吸收的热量是88.0KJ
B.水由液态变气态是一个吸热反应
C.1g氢气燃烧生成气态水可放出120.9KJ热量
D.若将1mol液态水加热分解为氢气和氧气,至少要吸收285.8KJ热量
15.经测定某溶液中只含NH4+、C1- 、H+、OH-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H20
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
14.以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1molH3O+中含有NA个电子
B.标准状况下,11.2L臭氧中含有NA个氧原子
C.2g重氧水(H218O)、含有NA个中子
D.84gNaHCO3晶体中含有NA个CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com