
题目列表(包括答案和解析)
(三) 实验试剂:标准浓度的盐酸、甲基橙。
(二) 实验原理:(写出有关离子反应方程式):_____________________________,
(一) 实验目的:________________________________________________________;
26、(A题)某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
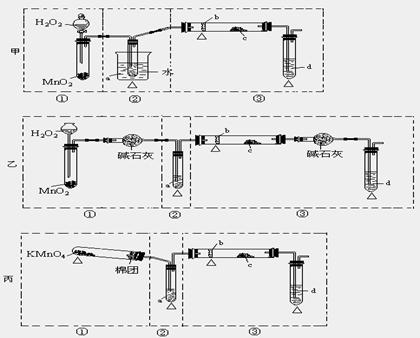
(1)简述三套方案各自的优点
甲:_______________________________________________________
乙:_______________________________________________________
丙:_______________________________________________________
(2)集中三套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为_____________________(例如甲①,乙②,丙③)
(3)若要保证此实验有较高的效率,还需补充的仪器有________________________。
理由_________________________________________________。
(4)实验中能验证乙醇氧化产物的实验现象是__________________________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式______________________________。
26、(B题)有一工业烧碱(含氯化钠),现要求学生采用学习过的定量实验的方法测定此工业烧碱中氢氧化钠的质量分数(假设各步实验,试样的损失忽略不计),请完成如下实验报告。
实验报告
25、在一定条件下,xA+yB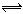 zC的可逆反应达到平衡。
zC的可逆反应达到平衡。
(1) 已知A、B、C都是气体,在减压后平衡向逆反应方向移动,则x、y、z的关系是 。
(2) 已知C是气体,且x+y= z,在加压时,如果平衡发生移动,则平衡必须向 方向移动。
(3) 已知B、C是气体,现增加A物质的量(其他条件不变),平衡不移动,则A是____ 态。
(4) 加热后C的质量分数减少,则正反应是 热反应
24、(B题)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体格能的是 。
A.Na+(g)+Cl-(g) →NaCl(s); △Q B.Na(s)+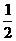 Cl2(g) →NaCl(s); △Q1
Cl2(g) →NaCl(s); △Q1
C.Na(s) →Na(g); △Q2 D.Na(g)-e-→Na+(g); △Q3
E.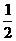 Cl2(g) →
Cl(g); △Q4 F.Cl(g)+e-→ Cl-(g); △Q5
Cl2(g) →
Cl(g); △Q4 F.Cl(g)+e-→ Cl-(g); △Q5
(2)写出△H1与△Q、△Q2、△Q3、△Q4、△Q5之间的关系式 。
若氧化亚铁晶体结构氯化钠晶体结构相似,则:
(3)氧化亚铁晶体中,跟二价铁离子紧邻且等距的氧离子个数是 。
(4)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将______ (填“减少”、“增多”或“保持不变”)。
23、北京时间10月15日9时42分,我国在酒泉卫星发射中心成功的发射了“神舟”五号载人飞船。这标志着“炎黄子孙千年飞天梦想实现了,中国人的太空时代开始了。” ⑴火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是________; A、在高温下不融化 B、在高温下可分解气化 C、在常温下就分解气化 D、该涂料不可能发生分解 ⑵ 火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是: N2O4 + N2H4 → N2 + H2O 。请配平该反应方程式: ----N2O4 + ----N2H4 → ----N2 + ----H2O 该反应中被氧化的原子与被还原的原子物质的量之比是 。 这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 _______________________________________________。 ⑶为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。 你选择的供氧剂是: ,原因是: ___________________ 。
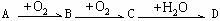 。
。
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,且D为强电解质,则A、D分别为(填写化学式)A: ,D: 。
写出A→B转化的化学方程式: 。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。则A为 ,写出A→B转化的化学方程式:
(3)若A为周期表中短周期元素形成的单质,D为强碱,写出C的电子式________;
(4)若A为短周期元素形成的非金属单质,除(1)、(2)中涉及到的元素外,A还有2种情况,请写出其中一种B→C的化学反应方程式 。
22、取χg铜和镁的合金完全溶于浓硝酸,若反应中硝酸被还原只产生8960mL的NO2气体和672mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为17.02g,则χ等于
A、8.64g B、9.00g C、9.20g D、9.44g
II卷(共84分)
21、用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是
A、Ca2+、K+、Cl- 、NO3- B、NH4+、Fe2+、 I一、SO42-
C、Na+ 、K+、ClO-、S2- D、Na+、S2O32-、AlO2- 、K+
20、运用元素周期律知识分析下面的推断,其中不正确的是
A、铍(Be)的氧化物的水化物可能具有两性
B、砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但溶于水也溶于稀酸
C、硫酸锶(SrSO4)是难溶于水的白色固体
D、硒化氢(H2Se)是无色、有毒,比H2S稳定的气体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com