
题目列表(包括答案和解析)
23.(10分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A 和B原子有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍; C燃烧时呈现黄色火焰, C的单质在加热条件下与B的单质反应, 可以得到与D单质颜色相同的固态化合物;D的最高价与最低价代数和为其最低价绝对值的两倍,试根据以上叙述回答:
(1)写出A与B两元素所形成化合物的结构式为 ______________;(2分)
该化合物分子所含有的化学键属于(极性键或非极性键)______________;(1分)该化合物分子属于(极性分子或非极性分子)______________;(1分)
(2)用电子式表示C与B两元素可能形成的化合物______ _____ ;(2分)
(3)画出D的原子结构示意图 ___________________,(2分)
用电子式表示C与D两元素构成的化合物的形成过程
_______________________________________________。(2分)
22.(10分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
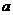
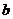
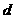
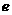
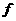
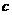
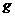
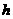
(1)上述元素的单质中熔点最高的可能是______(填字母)。
(2)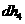 和
和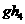 的化学性质相似,其原因是_____________________________________________________的缘故。
的化学性质相似,其原因是_____________________________________________________的缘故。
(3)“神舟”五号飞船内需要有一种化合物来吸收航天员呼出的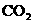 ,你认为该物质应该是由上表中的______(填字母)元素组成的。飞船中需要制造一种适合航天员生存的人工态环境,应该在氧气中充入一种稀释气体,该气体分子式为________。
,你认为该物质应该是由上表中的______(填字母)元素组成的。飞船中需要制造一种适合航天员生存的人工态环境,应该在氧气中充入一种稀释气体,该气体分子式为________。
(4)在一定条件下,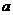 与
与 可形成一种化合物,其晶体类型为_______;该物质溶于水后的溶液呈_____性(填“酸”、“碱”或“中”)。
可形成一种化合物,其晶体类型为_______;该物质溶于水后的溶液呈_____性(填“酸”、“碱”或“中”)。
(5)现有另一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,则X是周期表中_____族元素。
21.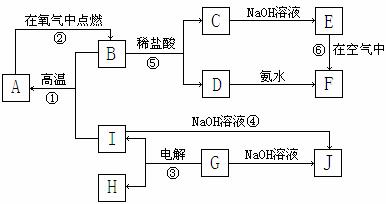 (11分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(11分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置___________________。
⑵写出C、G物质的化学式。
C____________________ G______________________
⑶写出①、④、⑥反应的化学方程式。
反应①:___________________________________________________________
反应④:___________________________________________________________
反应⑥:___________________________________________________________
⑷从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
|
|
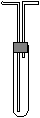 a.H2,b.Cl2,c.CH4,d.HCl,
e.NH3,f.NO,
g.H2S,h.SO2
a.H2,b.Cl2,c.CH4,d.HCl,
e.NH3,f.NO,
g.H2S,h.SO2
(1)若试管是干燥的,则由B口进气可收集的气体有
(写序号下同)。
(2)若试管充满水,可收集的气体有 ,这时气体由 口进入。
(3)若试管是干燥的,则A口进气,可收集的气体有 。
(4)若在试管内装入浓硫酸进行气体干燥,则可用此装置来干燥的气体有 ,这时气体由 口进入。
20.(8分)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式: 。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+
[∶OH ]-  H∶OH
H∶OH
试指出下列两个反应中的酸或碱
① H3BO3 + H2O= H+ + B(OH)4- 该反应中的碱是 (填:H3BO3 或 H2O)
②NaH + H2O = NaOH +H2↑ 该反应中的酸是 (填:NaH 或 H2O)
18.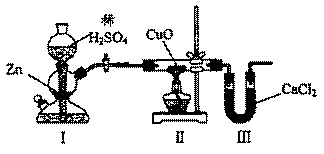 用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
A.I、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
第Ⅱ卷(非选择题 共76分)
17. 用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
A.在SiO2晶体中,若含有1mol Si原子,则Si-O键数为4NA
B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子
C.23.4 g NaCl晶体中含有6.02×1022个下图所示的结构单元
D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1N
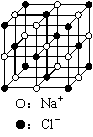
16. 常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO
B.Na2CO3 NaHCO3 K2CO3
C. AgNO3 KNO3 Na2CO3
D.(NH4)2SO4 K2SO4 NH4Cl
15.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质是强碱溶液。下面关于甲烷燃料电池的说法正确的是
A.负极反应为O2+2H2O+4e==4OH--
B.负极反应为CH4+10OH--8e==CO32-+7H2O
C.放电时溶液中的阴离子向负极移动;
D.随放电的进行,溶液的pH不变。
14.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下224mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
A.11.2g B.2.8g C.5.6g D.无法计算
13.核能是能量的重要来源,用少量的核燃料可以获得十分巨大的能量,lmol天然气中的甲烷完全燃烧时,放出882.8kJ的热,而lmol锂核跟lmol氢核生成2mol氦核的核聚变反应,放出的热量高达9.6×108KJ。有关锂原子和锂的化合物的说法错误的是
A.质量数为7的锂原子核内中子数是4
B.锂原子的半径比钠原子的半径小
C.锂与钠、钾不同,锂保存在石蜡中
D.氢氧化锂的碱性比氢氧化钠强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com