
题目列表(包括答案和解析)
7.下列方法能使电离平衡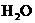

 向右移动,且使溶液呈酸性的是(B )
向右移动,且使溶液呈酸性的是(B )
A.向水中加入少量硫酸氢钠固体 B.向水中加入少量硫酸铝固体
C.向水中加入少量碳酸钠固体 D.将水加热到100℃,使水的pH=6
 8 .利用右图装做下面的实验:在烧杯里盛半杯乙溶液,
8 .利用右图装做下面的实验:在烧杯里盛半杯乙溶液,
然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入
甲溶液,电灯又会逐渐亮起来。下列各组溶液中
(甲在前,乙在后),能够产生上述现象的是(D )
A.NH3·H2O、AgNO3
B.CH3COOH、NH3·H2O
C.NaOH、AlCl3 D.H2SO4、Ba(OH)2
6.健康人血液的pH总是维持在7.35-7.45之间,这是由于 ( D )
A.人体内含有大量水分 B.血液中NaCl的含量保持恒定不变
C.人体排出的酸性物质与碱性物质部分溶解在血液中
D.血液中 和
和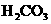 只允许在一定的比例范围
只允许在一定的比例范围
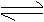
5.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( C )
A.恒温下向溶液中加CaO,溶液的pH升高 B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
4.为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg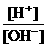 .下列叙述正确的是
( A )
.下列叙述正确的是
( A )
①任何温度下,水的AG等于0 ②溶液的AG越小,酸性越强
③常温下,0.1mol·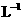 盐酸的AG=12
盐酸的AG=12
④25℃时,某溶液的AG=-10,其pH=10
 A.①③ B.②④ C.①② D.③④
A.①③ B.②④ C.①② D.③④
3.正常人胃液的pH在0.3-1.2之间,酸(一般以盐酸表示)多了,需要治疗.某些用以治疗胃酸过多的药物中含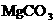 、
、 ,还有用酒石酸钠来治疗.这主要是由于C
,还有用酒石酸钠来治疗.这主要是由于C
A.对人体而言酒石酸是营养品 B.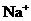 、
、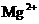 都是人体必需的元素
都是人体必需的元素
C.碳酸、酒石酸都不是强酸
D.MgCO3和NaHCO3与胃酸作用生成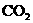 ,在服药后有喝汽水的舒服感
,在服药后有喝汽水的舒服感
2.相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( C )
A.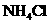 B.
B.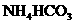 C.
C.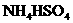 D.
D.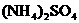
1.常温下某溶液中由水电离的c(H+)=10-10mol·L-1,该溶液中溶质不可能是( B )
A.NaHSO4 B.Al2(SO4)3 C.NaOH D.HCl
13.(12分)已知X为FeO和CuO的混合物,取两份等质量的X样品进行了①、②、③步实验,关系如下图(其中固体D不溶于稀盐酸):
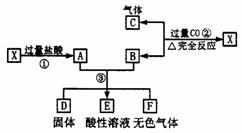
(1)写出物质D的化学式:________.
(2)若所得固体D的质量为32 g,溶液E中只含一种金属离子,气体F在标准状况下体积为5.6 L,试计算X中FeO与CuO的质量比(写出计算过程).
12.(22分)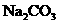 是一种很重要的化学物质,某学生拟在实验室中制备.下面是他的实验过程.
是一种很重要的化学物质,某学生拟在实验室中制备.下面是他的实验过程.
用50 mL NaOH溶液吸收 气体制备
气体制备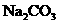 .为了防止通入的
.为了防止通入的 过量而生成
过量而生成 ,他设计了如下步骤:(ⅰ)用25 mL NaOH溶液吸收过量的
,他设计了如下步骤:(ⅰ)用25 mL NaOH溶液吸收过量的 气体,至
气体,至 气体不再溶解;(ⅱ)小心煮沸溶液1-2 min(此时
气体不再溶解;(ⅱ)小心煮沸溶液1-2 min(此时 不分解);(ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合.试回答:
不分解);(ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合.试回答:
(1)他能否制得较纯净的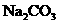 ________(选填“能”或“不能”)请说出理由.
________(选填“能”或“不能”)请说出理由.
(2)按他的设计,第(i)步实验装置如下图:

①装置A使用的试剂是石灰石和盐酸溶液,一般不用纯碱代替石灰石,原因是什么?
②装置B使用的试剂是________,作用是________________.
③为了后续的煮沸、混合等实验,装NaOH溶液的容器还可使用________(填仪器名称).
④有同学认为实验步骤(ⅱ)与(ⅲ)的顺序对调,即先混合,再煮沸,更合理,你认为对吗?________(选填“对”或“不对”).为什么?

11.(8分)下图四个装置,各工作一段时间后,溶液pH显著升高的是________;溶液中电解质质量不变的是________.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com