
题目列表(包括答案和解析)
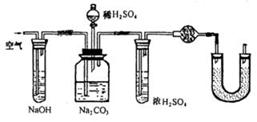
2.有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。请回答下列问题:
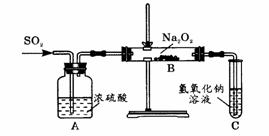
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
_________________________________________________________________________。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明两点理由:
① ;
② 。
1.请按要求填空:
(1)用已准确称量的1.06gNa2CO3固体配制0.100mol·L-1Na2CO3溶液100mL,所需要的仪器为: 。
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为: 、蒸发、结晶、 。
(3)除去KCl溶液中的SO42-离子,依次加入的溶液为(填溶质的化学式): 。
[例1]:用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
 (1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
(2)除去蒸馏水中溶解的O2常采用_________________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是________________________。
方法二:如右图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是__________________________。
(2)在试管Ⅱ里加入的试剂是________________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是___________。
[答案]:
方法一:(1)稀H2SO4、铁屑(2)煮沸(3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀H2SO4、铁屑 (2)NaOH溶液 (3)检验Ⅱ出口排出H2的纯度。当H2纯净时,再夹紧止水夹。
(4)试管Ⅰ中反应生成的H2充满试管Ⅰ和Ⅱ时,且外界空气不易进入,防止了Fe(OH)2被空气所氧化。
[例2]:实验室可用氯气与铁粉反应制备无水三氯化铁,该化合物是棕红色、易潮解,100℃左右时升华。如下图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别为Ⅰ和Ⅱ所示
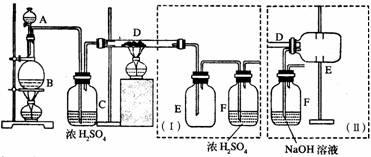
试回答:
(1)B中反应的化学方程式为:_____________________________________。
(2)D中的反应开始前,需要排除装置中的空气,应采取的方法是:_______________________________________________________________。
(3)D中反应的化学方程式为:_______________________________________。
(4)装置(1)的主要缺点是:__________________________________________。
(5)装置(Ⅱ)的主要缺点是:_________________________________________。
如果选用此装置未完成实验,则必须采取的改进措施是:____________________________。
[分析]:本题是将物质的制备与实验方案的设计与评价有机结合在-起的综合,性题目。
[题解]:本题要求制FeCl3,题中给出了FeCl3易潮解,能升华等性质对第(5)问的回答给予了暗示。(1)(3)问比较容易,(2)问为了避免产生氧化铁的杂质应在加热B之前先用C12将装置中的空气置换干净。而(4)(5)两问则要求学生对(Ⅰ)(Ⅱ)装置进行比较,结合装置的特点,联想到尾气处理,FeCl3遇水易水解等知识进行综合分析,得出正确结论。
[答案]:(1)4HCl(浓) + MnO2  MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
或16HCl + 2KMnO4  2KCl + 2MnCl2 + 8H2O
+ 5C12↑
2KCl + 2MnCl2 + 8H2O
+ 5C12↑
(2)B中反应进行一段时间后,看到黄绿色气体充满装置后再开始加热B
(3)2Fe + 3Cl2  2FeCl3
2FeCl3
(4)①导管易被产品堵塞;②尾气排入空气中,易造成环境污染。
(5)产品易受潮解 在瓶E和F之间连接装有干燥剂的装置。
[例3]:四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃,拟利用图中的仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。
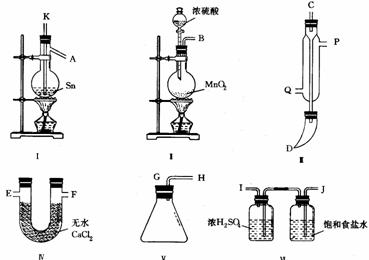
(1)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)________接________、________接________、________接________、________接________、________接________。
(2)装置Ⅵ的作用是___________;装置Ⅳ的作用是_____________。
(3)冷凝管理冷却水的流向是从__________进入,从__________流出。
(4)实验时应先点燃_____________处酒精灯,加热温度应大于______________℃,待__________即可停止加热。
(5)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________。
(6)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是____________。
(7)为了防止污染空气,在装置的最后应____________。
[分析]:这是一个制备实验。
实验目的是:制备无水SnCl4
实验原理是:Sn+2Cl2
 SnCl4
SnCl4
先制备Cl2:2H2SO4(浓)+2NaCl+MnO2
 Na2SO4+MnSO4+Cl2↑+2H2O
实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。
题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。
以上问题清楚了,实验方案就基本确定了。
[答案]:(1)B接J,I接K,A接C,D接G,H接E(或F)
(2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4
Na2SO4+MnSO4+Cl2↑+2H2O
实验的干扰因素是:SnCl4遇水强烈水解,因此,除去实验中水蒸气的干扰,是实验成败的关键。这里要分析水蒸气的来源以及除去水蒸气的措施。水蒸气的来自于制Cl2和空气中的水蒸气。
题目中提供的信息:SnCl4的性质在设计方案时要充分利用这些信息。
以上问题清楚了,实验方案就基本确定了。
[答案]:(1)B接J,I接K,A接C,D接G,H接E(或F)
(2)除去Cl2中混有的HCl和水蒸气,在制Cl2时发生的副反应2NaCl+H2SO4  2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
(3)a、p (4)I 231℃ Sn粒熔化
(5)SnCl4+2H2O
2HCl↑+Na2SO4,产生了HCl;防止空气中的水蒸气进入锥形瓶中使SnCl4发生水解。
(3)a、p (4)I 231℃ Sn粒熔化
(5)SnCl4+2H2O SnO2+4HCl (6)出现白色烟雾
(7)通入NaOH溶液中,吸收多余Cl2
SnO2+4HCl (6)出现白色烟雾
(7)通入NaOH溶液中,吸收多余Cl2
[例4]:为了测定工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl),某学生设计了实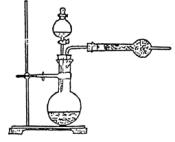 验装置如图
(1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为:
Na2CO3的质量分数=
验装置如图
(1)准确称取盛有碱石灰的干燥管的质量(设为W1)
(2)准确称取一定量纯碱样品(设为W0),并放入烧瓶中。从分液漏斗缓缓滴入稀硫酸,待不再发生气体后。称干燥管的总质量(设为W2)。设学生导出的计算公式为:
Na2CO3的质量分数= 
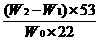 ×100%
试回答:
①W2-W1表示什么?
②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施。
[分析]:这是一道定量实验题
实验目的是:测定纯碱中 Na2CO3的质量分析
实验原理:稀H2SO4与Na2CO3反应生成CO2,测出CO2的质量即可求出Na2CO3的质量,继而求出Na2CO3的质量分数。
CO2的质量为(W2-W1)g,样品质量为W0g
Na2CO3+H2SO4
×100%
试回答:
①W2-W1表示什么?
②如果不计称量误差,该生的实验结果有无明显误差?如有,是偏大还是偏小?请简要说明根据并提出补救措施。
[分析]:这是一道定量实验题
实验目的是:测定纯碱中 Na2CO3的质量分析
实验原理:稀H2SO4与Na2CO3反应生成CO2,测出CO2的质量即可求出Na2CO3的质量,继而求出Na2CO3的质量分数。
CO2的质量为(W2-W1)g,样品质量为W0g
Na2CO3+H2SO4 Na2SO4+H2O+CO2↑
Na2SO4+H2O+CO2↑
 106 44
x W2-W1
x=
106 44
x W2-W1
x= 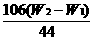 g
=
g
= 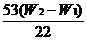 g
Na2CO3%=
g
Na2CO3%= 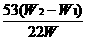 ×100%
产生误差的原因(即干扰因素)有烧瓶的CO2不能都被碱石灰吸收,实验值偏低。CO2气体混有的水蒸气和空气中的水蒸气被碱石灰吸收,使实验值偏高,两个因素综合考虑,CO2的影响是主要的,所以实验值偏低。
补救的办法:如上图。
①将蒸馏烧瓶改为集气瓶,利于排出CO2。
②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。
③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气;
④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。
[例5]:实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应:6Cl2 + 6Ca(OH)2
×100%
产生误差的原因(即干扰因素)有烧瓶的CO2不能都被碱石灰吸收,实验值偏低。CO2气体混有的水蒸气和空气中的水蒸气被碱石灰吸收,使实验值偏高,两个因素综合考虑,CO2的影响是主要的,所以实验值偏低。
补救的办法:如上图。
①将蒸馏烧瓶改为集气瓶,利于排出CO2。
②向集气瓶中通入(已除去CO2)空气,用空气将烧瓶中Cl2尽量排出去。
③在干燥管前连接盛有浓H2SO4的试管,以除去水蒸气;
④在U型管中装有碱石灰,以吸收空气中的CO2气体,经过这些补救措施,实验误差可以降低。
[例5]:实验室中用浓盐酸与MnO2制Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉,已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高即发生副反应:6Cl2 + 6Ca(OH)2 Ca(ClO3)2 + 5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
Ca(ClO3)2 + 5CaCl2+6H2O,现有三位同学设计的三套装置如图(U形管中放有玻璃纤维,可使气体顺利通过):
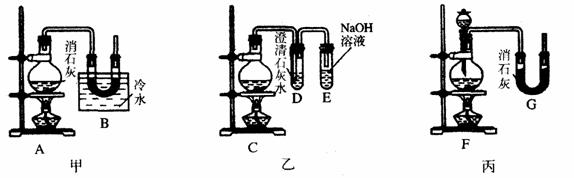
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内(错选、漏选、多选均倒扣分) a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生 d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)请从甲、乙、丙三装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流左到右方向)为_____________,在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,说明原因_____________________。 [分析]:这是一道评价实验方案的题。该题从是否有副反应发生,是否易控制反应速率,是否防止污染,是否干扰反应产物等方面进行评价。 [答案]:(1)
|
|
优点 |
缺点 |
|
甲装置 |
d |
a、e |
|
乙装置 |
f |
a、c |
|
丙装置 |
b |
e、c |
(2)F-B-E 在Cl2中混有HCl,应在烧瓶和凹形管之间连接一个盛有饱和食盐水的试管,以除去HCl气体。
[例6]:“卤块”的主要成份为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得轻质氧化镁。如果要求产品尽量不含杂质离子,而且成本较低。流程中所用试剂或pH控制可参考下表确定。
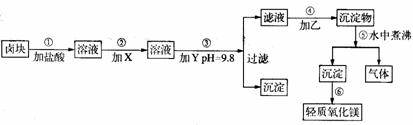
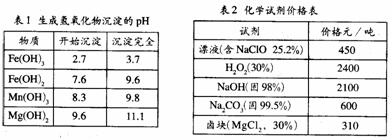
注:Fe2+氢氧化物呈絮状,不易从溶液除去,所以常将它氧化成为Fe3+生成Fe(OH)3沉淀而除去。请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应_______,其作用是___________。
(2)在步骤③加入的试剂Y,应是_________,之所以要控制pH=9.8,其目的是___________________。
(3)在步骤⑤时发生反应的化学方程式是_________________。
[解析]表1数据很明显,步骤③调控pH=9.8,是为了将所有的杂质金属离子 都变成氢氧化物沉淀除去。尽管此时Mg2+也可能部分生成Mg(OH)2沉淀从而影响产率,但卤块价格便宜,损失一些产量以保证产品(MgO)的纯度,还是可行的技术路线。再回头看步骤②由表1注Fe(OH)2,沉淀在实际操作中不易除尽,而Fe(OH)3却极易沉淀完全(pH>3.7),所以加入的试剂X应该是一种氧化剂。由表2看出,选用价廉的漂液最为合适。其反应式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,步骤④乙为Na2CO3,反应是Mg2++CO32-=MgCO3↓,步骤⑤有CO2气体产生,因而所得Mg(OH)2沉淀疏松,所以灼烧最终产物MgO具有轻质特点。
[答案](1)选漂液 将Fe2+氧化为Fe3+
(2)NaOH 将所有杂质金属离子都变成氢氧化物沉淀而除去
(3)MgCO3
+ H2O  Mg(OH)2
+ CO2↑
Mg(OH)2
+ CO2↑
本次周测选择题失分较多的有:5、8、9、12、13、15、16、17、18和21
23.(10分)某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3、(NH4)2SO4溶液中的两种或两种以上混合而成。取该溶液,向其中加入稀硫酸,有白色沉淀生成;继续加入稀硫酸,沉淀又完全消失,整个实验过程中无气体产生。
(1)原溶液是由 和 溶液混合而成的。
(2)整个过程中,有关反应的离子方程式是 、
、 。
班别_____________姓名 __________座号____________ 分数_______________
22.(本小题共8分)
(1)已知氢氧化铁可以被次氯酸钠氧化成FeO4n-,当3.21gFe(OH)3参加反应时,反应中共转移了5.418×1022个电子,则n= ,FeO4n-中铁的化合价为 。
(2)根据上题推断结果,配平下列离子方程式:
[ ]Fe(OH)3+ [ ]ClO- + [ ]OH--- [ ]FeO4n-+[ ]Cl-+[ ]H2O
(3)结合以上反应,推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
21.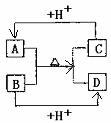 (本小题共10分) A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:
(本小题共10分) A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:
(1)A、D的电子式分别为:A____________,D_______________。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x________,y__________,z________
19.(7分)在0.5mol·L-1纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是 ;其原因是(用离子反应方程式和简要文字说明):__________________ ________________________________ ________________ ___________________________
18. 2001报道硼和镁形成的化合物刷新了金属化合物最高温度的记录。右图示意的是∶该化合物的晶体结构单元;镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子;6个硼原子位于棱柱内。则该化合物的化学式可表示为
 (
)
(
)
A.MgB
B.MgB2
C.Mg2B
D.Mg3B2
17.
 恒温恒压下,在容积可变的容器中,反应2NO2(g)
N2O4 (g)达到平衡后,再
恒温恒压下,在容积可变的容器中,反应2NO2(g)
N2O4 (g)达到平衡后,再
向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com