
题目列表(包括答案和解析)
7.下图是一种正在投入生产的大型蓄电系统。左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2(右罐)和NaBr3(左罐),放电后,分别变为Na2S4和NaBr。下列说法正确的是
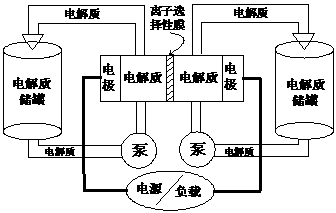
A.电池充电时,阳极电极反应式为:3Br-2e-=Br3-
B.电池放电时,负极电极反应式为:2S22-+2e-==S42-
C.电池放电时,电池的总反应方程式为:Na2S4+3NaBr=2Na2S2+NaBr3
D.在放电过程中Na+通过膜的流向为从左到右
6.右图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g) N2O4(g);△H<0。则以下说法正确的是
N2O4(g);△H<0。则以下说法正确的是
A.保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B.打开K一会,再关闭它,向右推动活塞时,最后A容器的气体颜色比B的浅
C.打开K一会,再关闭它,把A容器加热,活塞向右移动,A中气体颜色变浅
D.打开K一会,再关闭它,向B中通入氩气,B中气体颜色变浅
5.取0.2mol·L-1HX溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH = 8,则下列说法(或关系式)不正确的是
A.混合溶液中由水电离出的c(OH¯)>0.2mol·L-1HX溶液中由水电离出的c(H+)
B.c(Na+) = c(X¯) + c(HX) = 0.2mol·L-1
C.c(Na+)-c(X¯) = 9.9×10-7mol·L-1
 D.c(OH¯)-c(HX) = c(H+) = 1×10-8mol·L-1
D.c(OH¯)-c(HX) = c(H+) = 1×10-8mol·L-1
4.2005年12月1日为世界第18个艾滋病日,截至2005年9月底,全国累计报告艾滋病病毒感染者超过13万。医学界通过放射性14C标记的C60,发现C60的羧酸衍生物在特定条件下可断裂DNA杀死细胞,抑制艾滋病。关于14C的下列说法中正确的是
A.14C原子与C60中普通碳原子的化学性质不同
B. 14C原子与14N原子所含中子数相同
C.与12C、13C是碳元素的三种同位素
D.是C60的同素异形体
3.设NA表示阿伏加得罗常数,下列叙述正确的是
A.标准状况下,11.2L氦气所含的原子数为NA
B.1.6gNH2-离子中所含的电子数为NA
C.常温常压下,44g二氧化碳分子中所形成的共用电子对数为2NA
D.NA个氮分子和NA个氢分子的体积比是1︰1
2.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1︰16,则x值是
A.2 B.3 C.4 D.5
1.某溶液能使红色的石蕊试纸先变蓝色后褪色,则该溶液中可能大量共存的离子组是
A.K+、I-、AlO2-、HCO3-、MnO4- B.Na+、S2- 、NO3-、SO32-、SO42-
C.Fe2+、Al3+、NH4+、NO3-、F- D.K+、Na+、Cl-、ClO-、CO32-
5.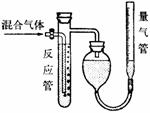 工业上测量SO2、N2、O2混合气体中SO2含量的装置如图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
工业上测量SO2、N2、O2混合气体中SO2含量的装置如图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):
SO2+I2+2H2O→H2SO4+2HI
(1)混合气体进入反应管后,量气管内增加的水的体积等于________的体积。(填写气体的分子式)
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量_________。(选填“偏高”、“偏低”或“不受影响”)
(3)反应管内的碘的淀粉溶液也可以用_________代替。(填写物质名称)
(4)若碘溶液体积为VamL,浓度为c mol/L。N2与O2的体积为VbmL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量为: ____________________________________。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为____________。(选填下列仪器的编号)
a. 烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
4.航天飞行器座舱内空气更新过程如下图所示。

空气更新流程
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式_____________________________。
(2)从装置Ⅰ、Ⅱ、Ⅲ可看出,O2的来源是CO2和H2O,宇航员每天消耗28molO2,呼出23molCO2,则宇航员每天呼出的气体中含H2O______mol。
(3)图7是另一种将CO2转化为O2的实验设想:
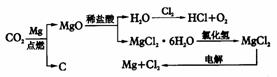
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下图。
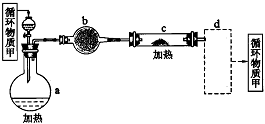
①上图中,装置a由_________、_________、双孔塞和导管组成。
②循环物质甲的名称是__________________。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是________________________。
④装置b中填充的物质可能是__________(填入编号)。
c.硅胶 f.碱石灰 g.无水氯化钙 h.浓硫酸
⑤设计d装置要注意防止倒吸,请在方框中画出d装置的简图,并要求与装置c的出口处相连(铁架台不必画出)。
3.某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g,锥形瓶和水的质量为190.720
g),利用图4装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如下表。

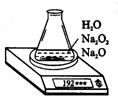
(1)写出Na2O2和H2O反应的化学方程式_________________________________________。
(2)计算过氧化钠质量分数时,必需的数据是______。不必作第6次读数的原因是______。
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下图。
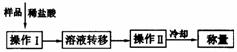
①操作Ⅱ的名称是________________。
②需直接测定的物理量是__________________。
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要_____、_____(固定、夹持仪器除外)。
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果_____(填偏大、偏小或不变)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com