
题目列表(包括答案和解析)
3.烧瓶
(1)识别 烧瓶包括圆底烧瓶、平底烧瓶、蒸馏烧瓶。
(2)用途 烧瓶一般作为有液体参加的反应器,也可以装配气体发生器,特殊情况下可用作气体收集装置。蒸馏烧瓶多用于液体的蒸馏与分馏。
 (3)使用方法
(3)使用方法
①加热前烧瓶外壁必须擦干,并垫上石棉网。
②加热时用铁架台固定
③加热时液体量应为容量的1/3-2/3之间
④煮沸、蒸馏时要加几粒沸石或碎瓷片。
[例4]下列仪器:①烧杯 ②蒸发皿 ③平底烧瓶 ④试管 ⑤坩埚 ⑥锥形瓶 其中可以用酒精灯直接加热的仪器为( )
A.①②④⑤⑥ B. ②④⑤ C.①④⑥ D.④⑥
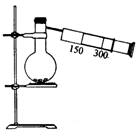 [例5]如图(图中有部分仪器末画出),有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连,烧瓶中有0.384gCu片,现向烧瓶中加入18mL 2.5mol/L的稀HNO3溶液,并立即用锡箔包住的橡皮塞封住瓶口。
[例5]如图(图中有部分仪器末画出),有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连,烧瓶中有0.384gCu片,现向烧瓶中加入18mL 2.5mol/L的稀HNO3溶液,并立即用锡箔包住的橡皮塞封住瓶口。
试回答:
(1)欲提高Cu和稀HNO3的反应速率,可采取多种不同的措施:
①若采用加入化学试剂的方法,可加入___________。
A.水 B.无水醋酸钠 C.铂丝 D.硝酸锌
②若用升高温度的方法,还需用的仪器有__________。
(2)橡皮塞用锡箔包住的原因是__________。
(3)反应开始后,烧瓶中可观察到的现象主要有____________
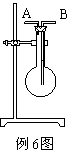 (4)停止反应后,轻轻推拉注射器活塞,使气体与气体、气体与液体皆充分反应。若忽略液体体积的变化,最终溶液中NO3-的物质的量浓度与开始时相比______________
(4)停止反应后,轻轻推拉注射器活塞,使气体与气体、气体与液体皆充分反应。若忽略液体体积的变化,最终溶液中NO3-的物质的量浓度与开始时相比______________
(A)不变 (B)变大 (C)变小 (D)无法确定
[例6] 利用如图所示装置收集以下8种气体(图中烧瓶的位置不得变化)。
①H2 ②C12 ③CH4 ④HCl ⑤NH3 ⑥N0 ⑦H2S ⑧SO2
(1)若烧瓶是干燥的,则由B口进气可收集的气体有____________(填序号)。
(2)若烧瓶充满水,可收集的气体有_____________,这时气体由_____口进入。
(3)若烧瓶是干燥的,则由A口进气,可收集的气体有______________。
(4)若在烧瓶内装人浓硫酸,进行气体干燥,则可用此装置来干燥的气体有_________这时气体由_________口进入。
2.烧杯
(1)识别 如图,有大、中、小不同规格
 (2)用途
(2)用途
①用作溶解试剂,配制一定浓度溶液。
②用作常温或加热时较多试剂之间的反应器
③可用于浓缩、稀释溶液。
④盛放具有腐蚀性药品进行称量
(3)使用方法
①烧杯用作反应容器和加热液体时,液体体积不超过烧杯容积的1/3
②在烧杯里配制溶液时,选用烧杯的容积应比所配溶液的体积大一倍为宜。
③加热前烧杯外壁必须擦干,并垫上石棉网。
④用玻璃棒搅拌烧杯中的溶液时,应注意不要碰触烧杯壁及底部。
⑤从烧杯中倾倒液体时应从杯嘴向外倾倒。
[例3]先选择填空,再简要说明作出选择的理由。
(1)某试管内装有约占其容积的1/10的溶液,则溶液的体积是(用字母回答,下同)_______,因为_______________________________________。
A.约1mL B.约3mL C.约10mL D. 无法判断
(2)拟在烧杯中于加热条件下配制其溶液 50mL,应选择的烧杯是_____________,因为_____________________________________________。
A. 400mL烧杯 B. 250mL烧杯 C. 100mL烧杯 D. 50mL烧杯
1.试管
 (1)识别 试管的形状为圆柱形弧底的玻璃仪器
(1)识别 试管的形状为圆柱形弧底的玻璃仪器
(2)常用规格 有大、中、小号不同的规格的试管。通常用
管长×管直径描述规格
(3)用途
①用作少量试剂的反应器
②可用于收集少量气体 ③可用作简易气体发生器④作洗气瓶用
(4)使用方法:
①在常温或加热时使用,可用酒精灯直接加热
②装液体时,液体不超过试管溶积的1/2,如需加热,则不超过1/3
③加热试管要用试管夹。加热前把试管外壁擦干,再使试管均匀受热,以防炸裂
④加热液体时,试管不要对着人,保持试管与台面倾角为45°
⑤加热固体时,试管横放,试管口略向下倾斜,先均匀受热,然后固定受热
⑥振荡试管时应用拇指、食指、中指拿离试管口的1/3处,用腕力
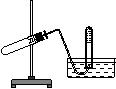 [例1]:下图装置可用于( )
[例1]:下图装置可用于( )
A.加热NaHCO3制CO2
B.用Cu与HNO3 反应制NO
C.用NH4Cl与浓NaOH溶液反应制NH3
D.用NaCl与浓H2SO4反应制HCl
[例2]下列实验不需要用到试管的是( )
A.实验室制取乙炔 B. 测量胆矾里结晶水的含量
C.实验定收集氨气 D. 实验室制取酚醛树脂
3。关于氮的氧化物的计算
在进行氮氧化物计算时,要注意有关循环氧化、由多步反应合并所得总反应的应用。记注下列反应:
4NO2 + O2 + 2H2O = 4HNO3 4NO +3O2 + 2H2O = 4HNO3
 NO2 +
NO + 2NaOH = 2NaNO2 + H2O 2NO2
+ 2NaOH = NaNO3 + NaNO2 + H2O
NO2 +
NO + 2NaOH = 2NaNO2 + H2O 2NO2
+ 2NaOH = NaNO3 + NaNO2 + H2O
例题精析
例1,使一定量的Zn 与100 mL 18.5 mol/L浓硫酸充分反应,Zn 完全溶解,同时生成标况下的气体A 33.6 L,将反应后的硫酸稀释至1 L,测得溶液中c (H+ )= 0.1mol/L,求气体A 中各组分的体积比?
例2,将12 mol/L的浓盐酸100 mL与足量的MnO2反应并将产物通入澄清石灰水中,完全反应后生成Ca(ClO)2 的物质的量为 ( )
A,等于0.15 mol B,大于0.15 mol C,小于0.15 mol D,无法确定
例3,为消除NO 、NO2 对大气的污染,常用a mol/L的NaOH 溶液进行吸收(已知反应:①NO2 +NO +2NaOH = 2NaNO2 + H2O ②2NO2 + 2NaOH = NaNO3 +NaNO2 + H2O )。现有m mol NO2 和n mol NO 组成的混合气体,用上述NaOH 溶液吸收至无色气体剩余,则需要上述NaOH 的溶液的体积是 ( )
A,m/a L B,(m+n)/a L C,2(m+n)/a L D,2m/3a L
例4,将38.4 g铜与含2 mol HNO3 的浓硝酸反应至铜完全溶解后,再向深液中加入铜时发现铜不能再溶解,则在铜完全溶解时所放出的气体在标况下的体积约为 ( )
A,17.92 L B, 22.4 L C, 8.96 L D, 11.2 L
2.关于浓酸变稀的问题
从上表中可看出三大强酸有一个共同的特点--浓度不同时所表现的性质有所不同,记住此点会给我们解题带来重要突破。记住下列反应:
4HNO3(浓) + Cu = Cu(NO3)2 + 2NO2 ↑+ 2H2O
8HNO3(稀) + 3Cu = 3Cu(NO3)2 + 2NO↑+ 4H2O
2H2SO4(浓)+ Zn = ZnSO4 + SO2 ↑+2H2O
 H2SO4(稀) + Zn = ZnSO4 + H2 ↑
H2SO4(稀) + Zn = ZnSO4 + H2 ↑
4HCl (浓 + MnO2 MnCl2 +Cl2 ↑+2H2O
1。三大强酸的对比
|
|
硝酸 |
硫酸 |
盐酸 |
|
重要物理性质 |
纯净硝酸为无色液体,常见浓硝酸因溶有分解产生的NO2 而呈黄色,易挥发。能以任意比与水混溶 |
无色油状液体,难挥发。能以任意比与水混溶 |
纯净盐酸为无色液体,常见盐酸含有工业杂质(Fe3+)而呈黄色 |
|
重要化学性质 |
强酸性;不稳定性,受热见光易分解;浓稀硝酸均有强氧化性 |
强酸性;稀硫酸只表现酸性,浓硫酸既表现酸性又表现吸水性、脱水性、强氧化性 |
强酸性;还原性(浓度越大还原性越强) |
|
实验室制法 |
硝酸钠与浓硫酸微热 |
|
氯化钠与浓硫酸强热 |
|
工业制法 |
NH3 ~NO~NO2 ~HNO3
注:NO循环氧化吸收 |
FeS2~2SO2 ~2SO3
~2H2SO4 注:SO2 循环氧化吸收 |
H2 在Cl2 中燃烧生成的HCl 用水吸收 |
9、在金属锂和碘化亚铜存在的条件下,卤代烃间发生反应生成一种新的烃,如: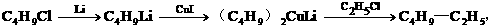
把下列各步变化中的有机产物的结构简式填入方框中:
8、某高校曾以下列路线合成药物心舒宁(又名冠心宁),它是一种有机酸盐。
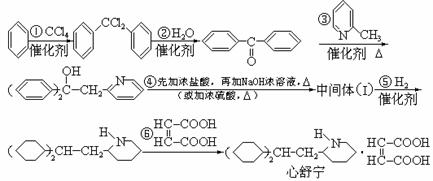
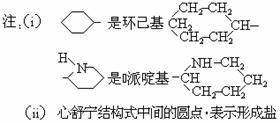 (1)心舒宁的分子式为 。 (2)中间体(I)的结构简式是
。
(3)反应①-⑤中属于加成反应的是
(填反应代号)。
(4)如果将⑤、⑥两步颠倒,则最后得到的是(写结构简式) 。
(1)心舒宁的分子式为 。 (2)中间体(I)的结构简式是
。
(3)反应①-⑤中属于加成反应的是
(填反应代号)。
(4)如果将⑤、⑥两步颠倒,则最后得到的是(写结构简式) 。
7、下图中①-⑧都是含有苯环的化合物.在化合物③中,由于氯原子在硝基的邻位上,因而反应性增强,容易和反应试剂中跟氧原子相连的氢原子相结合,从而消去HCl.请写出图中由化合物③变成化合物④、由化合物③变成化合物⑥、由化合物⑧变成化合物⑦的化学方程式(不必注明反应条件,但是要配平).
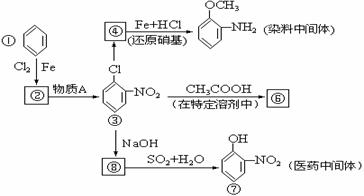
③→④ ③→⑥
⑧→⑦
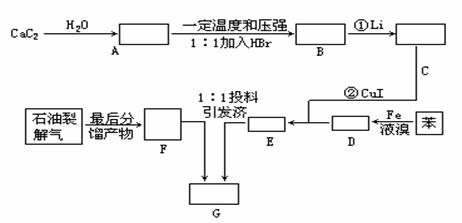
6、由乙烯和其它无机原料合成环状化合物E,其合成过程如下:
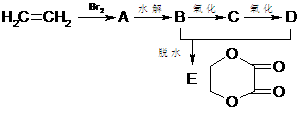
⑴写出A、B、C、D的结构简式A ,B , C ,D 。
⑵写出A和E的水解反应的化学方程式:
A水解: ;
E水解: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com