
题目列表(包括答案和解析)
25.(10分)卤代烃R-C1在一定条件下可发生如下反应:
|
|||
 |
|||

 R-C1
+ H2O
ROH+HCl R-C1 + KCN
R-CN
+ KCl
R-C1
+ H2O
ROH+HCl R-C1 + KCN
R-CN
+ KCl
R-CN
+ 2H2O + H+ R-COOH
+ NH
R-COOH
+ NH
以乙烯为原料经过下图所示的反应可制取有机物W(A、B、C、D、E均为烃的衍生物) 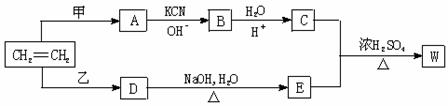
⑴若甲为Cl2 ,乙为HCl ,生成物W的分子式为C8H14O4 ,则W的结构简式为
__________________________________________________________
⑵若甲、乙均为C12,生成的W为最小环状分子,写出C
+ E W的化学方程式
。
W的化学方程式
。
⑶若甲、乙均为C12,生成的W为高分子,则W的结构简式为
⑷若W的分子式为C5H10O3则甲为________________,乙为__________。
24.(10分)右下图为某有机物的结构简式,每个节点处代表有一个碳原子,与其结合的氢原子的元素符号省略,这种化学式称为“键线式”。又知酯类在铜铬氧化物催化下,与氢气反应得到醇,羰基双键可同时被还原,但苯环在

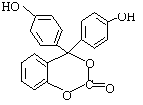 催化加氢过程中不变,其反应原理如下:
催化加氢过程中不变,其反应原理如下:
RCOOR’+2H2 RCH2OH+HO-R’
试填空:
⑴该有机物的的化学式为 。
⑵该有机物分子中的三个苯环________________共平面(选填“能”或“不能”)。
⑶1mol该有机物在铜铬氧化物催化下能与 mol氢气充分反应。
⑷该有机物与足量氢氧化钠溶液充分反应后的产物中,相对分子质量最小的钠盐的化学式为 。
23.(10分)A-L所代表的各物质是中学化学里常见的物质,已知B、J是单质,A是化合物;E的溶液跟石炭酸溶液混合,溶液呈紫色。A-L各物质之间相互反应转化关系如下图所示:
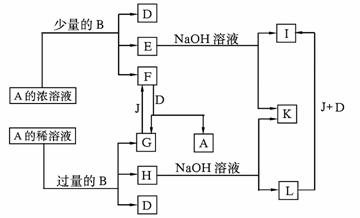
请回答:
(1)B在A的浓溶液中反应而溶解的条件是 ,而常温下B在A的浓溶液中难以反应而溶解的原因是 。
(2)写出下列化学方程式:
F→G+A ; G→F ;
E→I的离子方程式 。(3)L转化成I的现象是 。
22.(10分)现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。 为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40-50 mg碘酸钾。回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒。请简述其中所包含的化学原理 。
(2)KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液。总反应方程式为:KI+3H2O = KIO3+3H2↑(条件:电解),则两极的电极反应式分别为:阴极 ;阳极 。
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428 g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为 。为进一步确证该样品是否为合格产品,该生又用0.030 mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:I2+2S2O2-3 = 2I-+S4O2-6),由此通过计算可判断该加碘食盐为 (填“合格”或“不合格”)产品。
21.(14分)已知FeS0 在高温下分解生成Fe
在高温下分解生成Fe O
O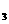 、S0
、S0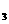 和SO
和SO 。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0
。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0 的质量。
的质量。

请回答下列问题:
(1)实验时,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是________________________________________________。
(2)A瓶内所盛试剂的作用是___________ __,A瓶要用冰水冷却的原因是_________________________________________________________________。
(3)检验后,用A瓶内的混合物测定FeS0 已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
(4)测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为a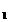 g,再次灼烧冷却至室温称量其质量为a
g,再次灼烧冷却至室温称量其质量为a g,且a
g,且a <a
<a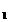 ,接下来的操作应当是_____________________________________________________________
。
,接下来的操作应当是_____________________________________________________________
。
(5)已经分解的FeS0 的质量是___________ (填计算式)。
的质量是___________ (填计算式)。
20.(10分)实验室用下图所示装置进行苯与溴反应的实验。

请回答下列问题:
(1)若装置中缺洗气瓶,则烧杯中产生的现象无法说明苯与溴的反应是取代反应,理由是____________ 。
(2)反应后得到的粗溴苯中溶有少量的苯、溴、三溴苯、溴化铁和溴化氢,可通过以下操作除去: ①水洗; ②碱洗; ③水洗; ④干燥; ⑤……。
其中,操作②碱洗的目的是 完成操作④干燥后,接下来的操作⑤是 (填操作名称)。
(3)如果省略(2)中的操作①,一开始就进行碱洗,会对后面的操作造成什么影响?(简要说明理由)____________________________________ 。
18. 某溶液c(H+)=10–2mol/L,则此溶液中不能大量共存的离子组是
A、Br–、Cl–、NH4+、Mg2+ B、Na+、K+、NO3–、Cl–
C、K+、Ba2+、I–、NO3– D、AlO2-、Na+、Cl–、SO42–
19. 现有pH=2的盐酸与pH=12的氨水等体积混合,混合后溶液中各离子浓度关系正确的是
(A)C(Cl-) >C(NH4+)>C(H+)>C(OH-)
(B)C(NH4+)>C(Cl-)>C(OH-)>C(H+)
(C)C(NH4+)=C(Cl-)>C(OH-)=C(H+)
(D)C(NH4+)+C(H+)=C(Cl-)+C(OH-)
第二卷(非选择题共83分)
17. 在20℃l.03×105Pa下,将三个分别盛满按4∶3混合而成的气体①NH3和O2②HCl和O2③NO和O2的烧瓶,分别倒置于盛水的水槽中,当水进入烧瓶,并使气体充分溶解后,假定烧瓶内溶液无损失,所得溶液的物质的量浓度之比是
A.1:1:1 B.5:5:4 C.7:7:4 D.1:1:2
16.下列化学式只能代表一种物质的是
A. CF2Cl2 B. P C. C2H6O D. NH2CH2COOH
14.下列反应的离子反应方程式中,书写正确的是
A.氟气通入水中:2F2+2H2O=4F-+4H++O2
B.向小苏打溶液中加入过量的石灰水:
Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C. 向氨水中通入过量二氧化碳: NH3·H2O+CO2=NH4++ HCO3-
D.FeBr2溶液与等摩尔Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com