
题目列表(包括答案和解析)
21.以下各物质均为中学阶段常见的化合物,它们的相互转化关系如下图所示:
(1)若在通常情况下能发生如图所示转变关系,
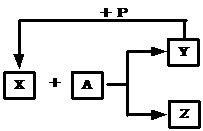 且常温下X为气态,A为非气态,则符合关系的有:
且常温下X为气态,A为非气态,则符合关系的有:
(请填写化学式)
|
X |
|
|
A |
|
(2)若X+A→Y+Z在常温下能进行,Y→X在
一定条件下进行,且A、Y为单质,则符合关系的有:
(请填写化学式)
|
|
第一种情况 |
第二种情况 |
|
X |
|
|
|
A |
|
|
(3)若X+A→Y+Z,Y→X均在一定条件下进行,且A、Y为单质,则符合关系的有:
(请填写化学式,可以不填满,也可以补充)
|
|
第一种情况 |
第二种情况 |
第三种情况 |
第四种情况 |
|
|
X |
|
|
|
|
|
|
A |
|
|
|
|
|
[答案]
(1)
|
X |
NO2 |
|
A |
H2O |
(2)
|
|
第一种情况 |
第二种情况 |
或 |
或 |
|
X |
H2O |
H2O |
HI(HBr) |
H2S |
|
A |
Na |
F2 |
Cl2 |
Cl2 |
|
|
|
第一种情况 |
第二种情况 |
第三种情况 |
第四种情况 |
或 |
或 |
或 |
||
|
X |
H2O |
H2O |
CO2 |
Fe3O4 |
SiO2 |
CuO |
CuO |
||
|
C |
Fe |
Mg |
Al |
C |
C |
H2 |
(其它合理答案同样给分) 22.有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:
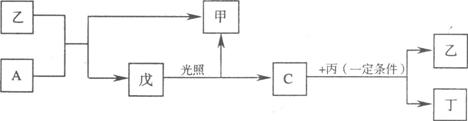
请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,则甲为_______,乙为___________。
(2)戊的结构式是______________,DB4+的电子式是_______________。
(3)丙+丁→D在一定条件下反应,是一种治理污染的好办法,写出该反应的化学方程式,
并标明电子转移情况:_____________________________________________________
[答案]⑴甲:HCl 乙:H2O ⑵H-O-Cl
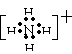 12e-
12e-

⑶4NH3+6NO=5N2+6H2O
20、已知:A和G是盐,且它们的元素组成相同,但它们溶液的颜色不同,B、C和D都是氧化物。反应过程中产生的水在图示中已略去。

回答下列问题:
(1)写出D生成C的化学方程式 2SO2+O2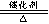 2SO3(2分)
2SO3(2分)
|
(3)A受热分解的化学方程式为:_2FeSO4 Fe2O3+SO2↑+SO3↑(2分)
(4)检验A中所含阴离子的方法是:取试样加盐酸酸化,再加入氯化钡溶液,有白色沉淀生成即为硫酸根。(3分)
[答案]
18.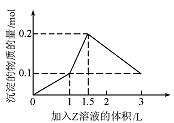 1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向该混合溶液中滴加某溶液Z(Z为0.1mol·L-1?的氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如右图所示,则X、Y、Z分别是
1L某混合溶液中,溶质X、Y的浓度都为0.1mol·L-1,向该混合溶液中滴加某溶液Z(Z为0.1mol·L-1?的氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如右图所示,则X、Y、Z分别是
A. 氯化铝、氯化铁、氢氧化钠
B. 氯化铝、氯化镁、氢氧化钠
C. 偏铝酸钠、氢氧化钡、硫酸
D. 偏铝酸钠、氯化钡、硫酸
[解析]从两个角度进行分析,第一:①氯化铝和氢氧化钠反应,产生氢氧化铝沉淀和氢氧化铝沉淀消耗的氢氧化钠比为3︰1,②偏铝酸钠和硫酸反应,产生氢氧化铝沉淀和氢氧化铝沉淀消耗的硫酸比为1︰3。结合图形可排除AB选项。第二:从氢氧化钡与氯化钡分别存在的情况分析,只要有氢氧化钡存在,硫酸与偏铝酸钠不反应,而氯化钡存在时,硫酸中的硫酸根与钡离子反应,硫酸中的氢离子与偏铝酸钠反应,所以,综合上述,C选项符合题意。
 [答案]C
[答案]C
19
第II卷(非选择题)
0.1 mol 0.2
mol 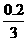 mol 0.2
mol
mol 0.2
mol
m(Al)=1.8 g m(Fe)=5.6 g 综合可知:n<m<1.8 g
且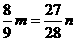 ,故选C。
,故选C。
[答案]C
17.在托盘天平的两个托盘上各放一个盛有50 mL 4 mol·L-1的盐酸的烧杯,把天平调整平衡,然后往一只烧杯中加入m g铝,另一烧杯中加入n g铁充分反应后天平仍然平衡,则m、n的关系可能为
A.?m=n≤5.6 g B.m=n=2.7g
C.?n<m<1.8 g D.m<n<2.7
g且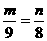
[解析] Al ~ 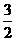 H2↑ Δm
H2↑ Δm
27 g 24 g
m 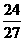 m?
m?
Fe ~ H2↑ Δm
56 g 54 g
n 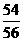 n
n
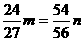 ?
?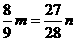 ??m>n?
??m>n?
又因为Fe ~ 2HCl Al ~ 3HCl
16.常温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法不正确的是
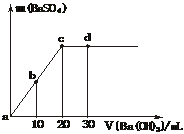
A.溶液的pH:a<b<c<d B.c处恰好完全反应
C.a、b溶液呈酸性 D.c、d溶液呈碱性
[解析]图中Ba(OH)2溶液慢慢加入H2SO4溶液中,pH应逐渐增大,即a<b<c<d,a、b处呈酸性,c处两溶质恰好完全反应呈中性,d处碱过量呈碱性。
[答案]D
15.图为用某物质的量浓度的NaOH溶液(Y),滴定10 mL某物质的量浓度的HCl溶液(X)的图象,据此推断NaOH溶液和HCl溶液的物质的量浓度是
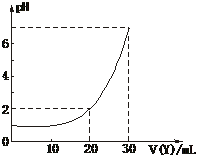
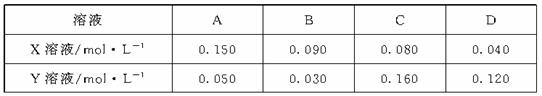
[解析]当NaOH溶液和HCl溶液恰好中和时c(NaOH(aq))·V(NaOH(aq))=c(HCl(aq))·V(HCl(aq)),由图象可知:当加入NaOH溶液30 mL时,两溶液恰好中和,3c(NaOH(aq))=c(HCl(aq)),排除C、D;当加入NaOH溶液20 mL时,溶液的pH=2,计算得c(NaOH(aq))=0.03 mol·L-1。
[答案]B
14.图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X)。纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气体,则C中n(A)∶n(B)为
A.2∶1 B.1∶2 C.1∶1 D.任意比
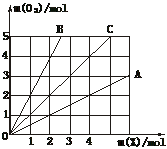
[解析]由图象可知1 mol A完全燃烧时消耗0.5 mol O2,1 mol B完全燃烧时消耗氧气2 mol,1 mol C(A、B的混合气体)完全燃烧需要1 mol O2,
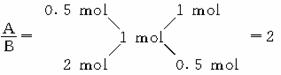
[答案]A
13..用于重返火箭发动机、航天飞机制动闸的金属要求有良好的热学性能,比如:熔点高、比热高、热导率高、适宜的热膨胀等优异性能。根据下表,可选择的最佳金属材料为
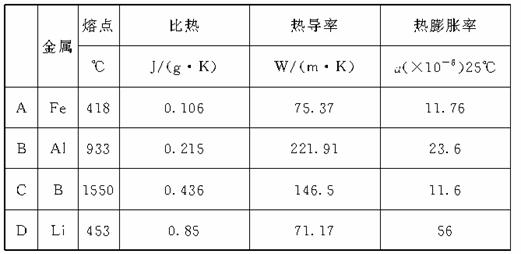
[解析]结合题目意思,分析表中数据,符合熔点高、比热高、热导率高、适宜的热膨胀率等只有Be最合适,故C选项正确。
[答案]C
12. 纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如右图),则这种纳米颗粒的表面粒子数与总粒子数的比值为
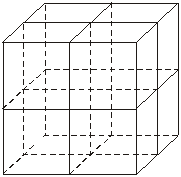
A.7∶8 B.13∶14 C.25∶26 D.26∶27
[解析]综合教材中氯化钠的晶胞结构知识,晶胞结构中的顶点,边的中点、面心、体心均存在Na+或Cl-,一个晶胞中表面粒子数为26,总粒子数为表面粒子数再加体心共27个。故选D。 [答案]D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com