
题目列表(包括答案和解析)
1、下列变化过程属于物理变化的是 ( )
A.电解质溶液使胶体凝聚
B.加热煮沸促使蛋白质溶液凝聚
C.煤的干馏
D.钠的化合物灼烧火焰呈黄色
30.如图I,在恒压密闭容器M中加入2molA和molB,起始时容器体积为V L,发生如下反应并达到化学平衡状态: 2A(?)+B(?)  x C(g);ΔH<0
x C(g);ΔH<0
平衡时A、B、C的物质的量之比为1:3:4,C的物质的量为y mol。
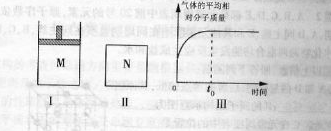
(1)根据题中数据计算,x= ,y= ;
(2)如图Ⅱ,在体积为VL的恒容密闭容器N中发生上述反应(其他条件相同),测得反应过程中气体的平均相对分子质量随时问的变化如图Ⅲ(t0时达平衡)所示,平衡时容器中C的物质的量zmol,由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①,可不填满):
|
可能的情形 |
A、B是否为气态 |
z与y的大小 关系 |
M(B)与M(C)的大小关系(M表示摩尔质量) |
|
|
A |
B |
|||
|
① |
是 |
不是 |
z=y |
前面的结论与此无关 |
|
② |
是 |
是 |
z<y |
前面的结论与此无关 |
|
③ |
不是 |
是 |
Z<y |
M(B)<M(C) |
29.指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):
②容量瓶:
[答案]①用蒸馏水湿润 ②检漏
28. 将18.7 g复盐Fe2(SO4)3·x(NH4)2SO4·yH2O加到过量的NaOH溶液中加热,生成的氨用100mL0.5mol/L硫酸吸收,多余的硫酸用2mol/L的NaOH溶液滴定,用去NaOH溶液25mL。再将等质量的复盐溶水配成溶液,加足量BaCl2溶液,充分反应后,过滤、洗涤、干燥,最后得白色沉淀23.3g。则该复盐中铁元素的质量分数为15.0%;x的值为1;y的值为12;复盐的摩尔质量为748g/mol。
27. 26.(10分)自然界存在着一种白云石的矿石.其化学式是 xCaCO3·yMgCO3.以它为原料,可制取耐火材料等。
(1)称取27.6g白云石,加热到质量不再变化,可以生成耐火材料MgO多少mol?(用x 、y的代表式表示)
(2)若在上述反应中,收集到CO2体积6.72L(标准状况下),试写出白云石的化学式(取x、y的最小正整数比)
(3)若把收集到6.72L CO2用来制取化肥,即将CO2通入200mL2.25mol/L氨水中,充分反应后,试确定溶液中CO32-和HCO3-的物质的量之比(不考虑离子的水解)
(4)若称取白云石m g,研碎后与过量炭粉混合,放在特定仪器中隔离空气强热一段时间后,测得白云石分解率为a,生成V L(S.T.P)一氧化碳。试计算V为多少L(S.丁.P)?(用m、a代数式表示)
(已知
CaO+3C  CaC2
+CO;2MgO+5C
CaC2
+CO;2MgO+5C Mg2C3+2CO)
Mg2C3+2CO)
[答案](1)n(MgO)=27.6y/(100x+84y) ;
(2) CaCO3·MgCO3
(3)1:1
(4) CaCO3·MgCO3 -- 6CO 分解白云石ma/184 mol产生n(CO) ==6ma/184 mol,则V(CO) ==(6ma/184)×22.4L ==0.73ma
26.(1)邻苯二甲酸氢钾(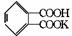 相对分子质量为204.2)可以用于标定NaOH溶液的浓度,反应如下:KHC8H4O4+NaOH
相对分子质量为204.2)可以用于标定NaOH溶液的浓度,反应如下:KHC8H4O4+NaOH KNaC8H4O4+H2O。准确称取KHC8H4O4晶体0.5105g,溶于水后加
入酚酞指示剂,用NaOH溶液滴定至溶液呈淡红色消耗NaOH20.00mL。计算NaOH溶液的物质的量浓度(结果保留4位有效数字)。
KNaC8H4O4+H2O。准确称取KHC8H4O4晶体0.5105g,溶于水后加
入酚酞指示剂,用NaOH溶液滴定至溶液呈淡红色消耗NaOH20.00mL。计算NaOH溶液的物质的量浓度(结果保留4位有效数字)。
(2)食醋中除醋酸外,还含有其他有机酸,食醋的总酸度以每1000mL食醋中含醋酸(其他酸也折算作醋酸)的质量(g)表示,通常写作CH3COOH%。用移液管移取市售食醋50.00mL,置于2 50mL容量瓶中,用水稀释至刻度。再从中移取25.00mL,用上小题已知浓度的NaOH溶液滴定 ,消耗碱液体积为V(mL),写出CH3COOH%的计算式。
(3)已知0.1mol/L邻苯二甲酸溶液的pH大于1,取等体积的邻苯二甲酸溶液和某KOH溶液混合,测得混合溶液的pH等于7,则碱与酸的浓度比值(x)为 (选填下列选项编号)。
A.x>2 B.x=2 C.2>x>1 D.x=1
E.1>x>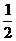 F.x=
F.x=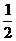
[解析](1)要求由质量、摩尔质量以及体积、浓度分别列出酸和碱的物质的量,再根据中和反应中酸碱物质的量关系列式求得碱的浓度。
∵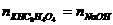
∴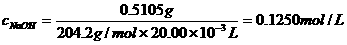
(2)在上题求得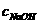 的基础上,同样利用酸碱中和反应,求得食醋稀释液中CH3COO
H的物质的量,经换算后得出C3COOH%的表示式。
的基础上,同样利用酸碱中和反应,求得食醋稀释液中CH3COO
H的物质的量,经换算后得出C3COOH%的表示式。
∵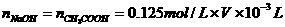
∴CH3COOH%=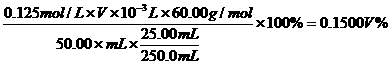
与第(1)题相比,由于需要经过换算以及正确理解CH3COOH%的含义,所以难度略有上升。
(3)要求学生能迅速接受并理解试题给出的两个信息,据此做出判断。这两条信息是:①由第(1)上题得知,KHC8H4O4可以进一步与NaOH发生中和反应,说明KHC8H4O4溶
液呈酸性(从指示剂颜色变化可知,它与NaHCO3不同,NaHCO3是呈弱碱性的)。②0.1mol /L邻苯二甲酸(H2C8H4O4)溶液的pH大于1,说明溶液的浓度大于电离出的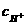 ,证明这是弱酸,既然是弱酸,当它完全中和后生成的正盐溶液应呈弱碱性(强碱弱酸盐
水解,溶液呈弱碱性),所以,邻苯二甲酸和KOH溶液混合后,若pH=7,说明邻苯二甲酸和第 一步中和反应(生成KHC8H4O4)已完全,即
,证明这是弱酸,既然是弱酸,当它完全中和后生成的正盐溶液应呈弱碱性(强碱弱酸盐
水解,溶液呈弱碱性),所以,邻苯二甲酸和KOH溶液混合后,若pH=7,说明邻苯二甲酸和第 一步中和反应(生成KHC8H4O4)已完全,即 >1,但第 二步中和反应(KHC8H4O4
>1,但第 二步中和反应(KHC8H4O4 K2C8H4O4)尚不完全,即
K2C8H4O4)尚不完全,即 <2,现在酸和碱的体积相同,所以
<2,现在酸和碱的体积相同,所以 在1 -2之间,即2>x>1,答案为C。
在1 -2之间,即2>x>1,答案为C。
[答案](1)0.1250moL·L-1
(2)CH3COOH%=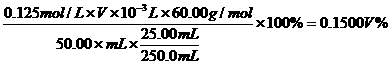 (3) C
(3) C
1.00×10-3mol·L-1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L-1H2SO4溶液备用。
③ 将2.00×10-3mol·L-1的草酸标准溶液置于 (填仪器名称)中备用。
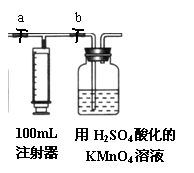
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?
_________________________________________________________;
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2-3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将 (填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)。 。
⑦ 再重复实验2次。
⑷ 数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 25.00mL):
|
装修后 第n天 |
草酸溶液(mL) |
甲醛的浓度 mg/m3 |
|||
|
1 |
2 |
3 |
平均值 |
||
|
1 |
15.86 |
15.72 |
15.67 |
15.75 |
|
|
7 |
26.17 |
26.36 |
26.38 |
26.27 |
|
|
30 |
30.90 |
30.67 |
30.81 |
30.79 |
|
设 KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为V1(mL);
草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为V2(mL)
则:计算室内空气中甲醛浓度(mg/m3)的代数式为 ,计算第30天室内空气中甲醛浓度为_____________(精确到小数点后二位),并判断此时主人________(填“能”或“否”)入住。
答:25.(12分)⑶ ②酸式滴定管或移液管,(1分) ③酸式滴定管;(1分)
④甲醛吸收不充分,影响测定结果;(1分)
⑤偏高;(2分)
⑥不需要,加入最后一滴草酸溶液时溶液褪色且半分钟内不重新变红(2分)
⑷ (75clVl-30c2V2) ×103;(2分) 27.60 (2分) 不能 (1分)
25.(12分)常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其它还原性气体):
 ⑴ 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,
⑴ 测定原理: KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,
化学反应离子方程式为:
4MnO4-+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
 2MnO4-+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
2MnO4-+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
⑵ 测定装置:部分装置如下图所示(a、b为止水夹)
⑶ 实验步骤:
① 检查装置气密性(气密性良好)。
② 用 (填仪器名称)准确移取25.00 mL
24.下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
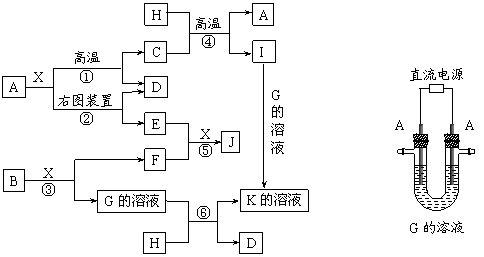


请按要求填空:
⑴写出B的电子式:______________________。
⑵写出生成E的电极反应式:______________________________________,反应⑤的现象是______________________________________。
⑶反应①的化学方程式是_____________________________________________,在实验室中引发反应④的操作是__________________________________________。
⑷反应⑥的离子方程式是_____________________________________________。
[答案]⑴Na+[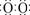 ]2-Na+ ⑵Fe+2OH――2e-=Fe(OH)2
]2-Na+ ⑵Fe+2OH――2e-=Fe(OH)2
白色物质迅速转变为灰绿色最终变为红褐色
⑶3Fe+4H2O Fe3O4+4H2 加少量KClO3,插上镁条并将其点燃
Fe3O4+4H2 加少量KClO3,插上镁条并将其点燃
⑷2Al+2OH-+2H2O=2AlO2-+3H2↑
23.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。
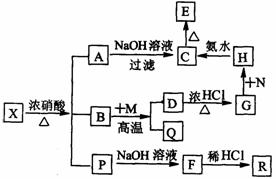 试填空:
试填空:
(1)X的化学式为 ▲ 。
(2)N最好选择下列物质中的 ▲ (填序号)
a.KMnO4 b.HNO3 c.H2O2 d.C12
(3)写出反应的离子方程式:
D+G ▲ ;H+C ▲ 。
(4)B+M反应的化学方程式: ▲ 。
[答案](1)Fe3C (2)cd (3)Fe3O4十8H+==Fe2++2Fe3++4H2O Fe3++3NH3·H2O==Fe(OH)3↓++3NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com