
题目列表(包括答案和解析)
3.在25℃时,有80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末a g,反应后温度恢复到25℃,下列有关该溶液的说法正确的是
A.溶液中c (Ba2+ ) 将增大 B.溶液的pH将增大
C.溶液中Ba2+ 总数将减少 D.溶液中c (OH- ) 减少
2.最近,医学家们通过放射性14C标记的C60发现: 一种C60羧酸衍生物在特定条件下可通过断裂DNA杀死细菌,从而控制爱滋病毒.下列有关14C的说法正确的是
A 与14N所含中子数相同
B 与C60均为碳的同素异形体
C 与12C互为同位素
D 质量数为14,原子序数为6,核内有8个质子
1.下列与“神舟六号”载人飞船有关的说法不正确的是
A.飞船的表面覆盖的一层石墨瓦之所以能起到保护作用是因为石墨能够耐高温
B.宇航员不能用电动剃须刀剃去胡须,目的是防止飞船内产生飘尘
C.飞船在宇宙中运行时,船舱内温度低、氧气少,无法划着火柴
D.运送飞船的火箭外壳涂的涂料应该是受热能气化和易分解的特殊涂料
3、可能的误差
①未及时测出最高温度--其值偏小
②使用一个量筒且未洗干净--其值偏小
③烧杯过大--其值偏小
巧思巧解
盖斯定律:一定条件下,某化学反应无论是一步完成还是分几步写成,反应的总热效应相同。即反应热只与始态和终态有关,而与反应的途径无关。
例:C(石墨s)+O2(g)== CO2(g);△H=-393.5kJ/mol CO(g)+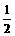 O2(g)==CO2(g);△H=-283.0kJ/mol,求C(s)+
O2(g)==CO2(g);△H=-283.0kJ/mol,求C(s)+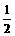 O2(g)的反应热。(110.5kJ/mol)
O2(g)的反应热。(110.5kJ/mol)
例题精析
例1 25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,下列表示该反应的热方程式正确的是 (D)
A CH4O(l)+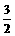 O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol-1
O2(g)==CO2(g)+2H2O(g);△H=-725.8kJ· mol-1
B 2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=+1451.6kJ· mol-1
C 2CH4O(l)+3O2(g)==2CO2(g)+4H2O(l);△H=-22.68kJ· mol-1
D CH4O(l)+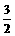 O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol-1
O2(g)==CO2(g)+2H2O(l);△H=-725.8kJ· mol-1
例2 某学生在测定强酸和强碱反应的中和热时,为了减少实验误差,采用保温杯装配成反应装置,并将酸、碱溶液的体积各增大为100mL。该学生用100mL 0.25mol/L盐酸和100mL 0.28mol/L NaOH溶液进行实验,测得中和反应前后溶液温度差的平均值为1.7℃。试回答:
(1)为什么将酸、碱溶液的体积增大。可以减少实验误差?
(2)实验测得的中和热为多少(假设HCl和NaOH溶液的密度均为1g· cm-3)?
产生的热量=4.18×m(aq)×△t,式中m为溶液的质量,由于未考虑容器的升温,所求热效应偏低,增加溶液的量可使容器吸相对减少,以减少误差。(56.85kJ· mol-1)
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1KJ,又知胆矾分解的热化学方程式为:CuSO4 5H2O  CuSO4 (s)+5H2O ;△H=+Q2KJ/mol,则Q1、Q2、(Q1、Q2均大于零)的关系为 ( )
CuSO4 (s)+5H2O ;△H=+Q2KJ/mol,则Q1、Q2、(Q1、Q2均大于零)的关系为 ( )
A、Q1<Q2 B Q1>Q2 C Q1=Q2 D 无法确定
0.55mol/L NaOH溶液,记录起始温度t1。
③混合反应并准确量取混合液最高温度,
记录终止温度t2。
④重复实验二次,取平均值。
⑤计算△H=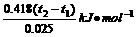
2、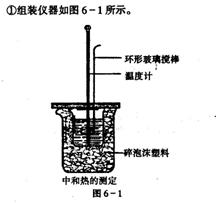 实验步骤:
实验步骤:
①组装仪器如图6-1所示。
②分别量取50mL 0.50 mol/L的盐酸和50mL
1、主要仪器:大烧杯(500mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
在101kPa时,1mol物质完全燃烧,生成稳定的氧化物时所放出的热量。
4、以下反应均非中和热:
①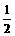 H2SO4(aq)+
H2SO4(aq)+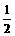 Ba(OH)2(aq)=
Ba(OH)2(aq)=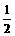 BaSO4(s)+H2O(l)(此处还有
BaSO4(s)+H2O(l)(此处还有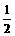 Ba2++
Ba2++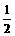
SO42―=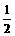 BaSO4↓
的反应热)。
BaSO4↓
的反应热)。
②NaOH(s)+HCl(aq)=NaCl(aq)+H2O(l)(此处还有NaOH的溶解热)。
③CH3COOH(aq)+NaOH(aq)=CH3COONa (aq)+H2O(l)(此处有CH3COOH的电离热)。
3、其值为57.3kJ/mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com