
题目列表(包括答案和解析)
26.(8分)某学生为了测定某种稀硫酸的物质的量浓度,用不同质量的纯锌粉与该稀硫酸进行反应。他的六次实验结果如下(计算结果精确到0.1):
|
实验编号 |
加入锌粉的质量(g) |
稀硫酸溶液的体积(mL) |
生成硫酸锌的质量(g) |
|
1 |
2.0 |
50.0 |
5.0 |
|
2 |
4.0 |
50.0 |
|
|
3 |
6.0 |
50.0 |
14.9 |
|
4 |
8.0 |
50.0 |
19.3 |
|
5 |
10.0 |
50.0 |
|
|
6 |
12.0 |
50.0 |
19.3 |
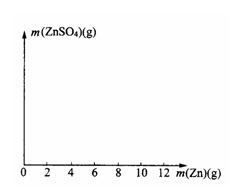 (1)其中第2、第5两个实验中生成硫酸锌的质量分别
(1)其中第2、第5两个实验中生成硫酸锌的质量分别
是_________g、________g。
(2)在右图中画出生成硫酸锌的质量[m(ZnSO4)]与加入锌粉质量[m(Zn)]的关系示意图(需要标明关键点的横坐标和纵坐标的数据)。
(3)若使(10+m)g锌粉与50.0mL上述稀硫酸充分反应,剩余固体的质量为__________g,该稀硫酸的物质的量浓度为________mol/L。
25.(8分)某石墨回收厂,为将回收的石墨棒处理成疏松状的碳粉,采用浓硫酸蒸煮废石墨棒的落后生产工艺,这种落后工艺所造成的恶劣后果是排入水体的废酸液导致严重环境污染。试完成下列问题:
(1) 用浓硫酸蒸煮石墨发生的化学方程式____________________________________
这种方法除废酸污染水体外,还将_________(填化学式)污染大气。
(2) 该厂每天向附近溪水中排放400吨废酸液,现某环保小组测得该溪水中污染指数如下:
|
PH值 |
水中悬浮物(mg/l) |
氟化物(mg/l) |
化学需氧量(CODmg/l) |
|
1.8 |
7143 |
3100 |
2670 |
以上数据表明氟化物超过国家规定标准310倍,COD超过国家规定标准260倍。
为净化这条溪水,除责令该厂停产整顿外,主管部门决定,建在这条溪水上游的某水库开闸放水以稀释污染物。请计算溪水的流量应为每秒多少立方米时才能使该溪水中氟化物、COD指标达到国家规定的排放标准,此时溪水的PH值为多少?(原小溪中水忽略不计)
22. (12)CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
(12)CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:

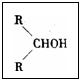
图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出:
(1)结构简式:E 、G 、R,基 。
(2)G的两个同类别同分异构体的结构简式(不带R字母) 。
(3)反应类型:X 、Y 、Z 。

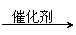 (4)写出下列转化的化学方程式:
(4)写出下列转化的化学方程式:
① A+CO+H2O E;②F+D H。
① ;
② 。
21.(10分)已知:①一定条件下,R-Cl + 2Na + Cl-R’ ® R-R’ + 2NaCl ②醛和醇可以发生氧化反应。相关物质被氧化的难易次序是:RCHO最易,R-CH2OH次之,最难。
现有某氯代烃A,其相对分子质量为78.5;B与氯气反应生成的一氯代物有两种。有关的转化关系如下图所示(部分产物及条件均已略去):
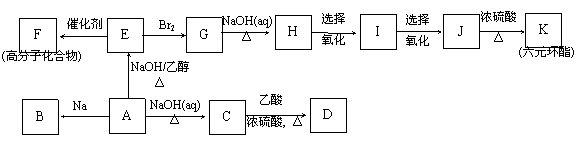
请回答下列问题:
(1)反应类型:A®C ,E®F ;
(2)结构简式:B , K为 ;
(3)反应方程式:A→E________________________________________________;
G→H________________________________________________;
(4)D的同分异构体属于羧酸的有四种,其中有2个-CH3基团的有两种。请写出这两种中的任一种结构简式: 。
19.(9分)已知A-L所代表的物质(或溶液中的溶质)都是中学化学里常见的物质。通常状况下,A、B均是淡黄色固体,D是气体单质,E是无色无味气体,K是不溶于水的酸。反应①-③是化学工业生产重要产品的全部反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如下图所示(反应时加入或生成的水均没标出)。
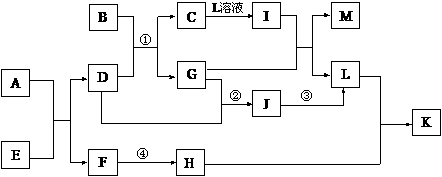
请填写下列空白:
(1)写出下列物质的化学式:H_________;D的同素异形体__________。(均填化学式)
(2)画出A中金属元素的原子结构示意图_____________;指出E分子中共价键的类型(填“极性键”或“非极性键”)____________。
(3)指出反应①②③是吸热反应,还是放热反应?____________。
(4)完成下列反应方程式:
① I+G→M+L的离子方程式:______________________________________。
② 写出反应④的化学方程式:_____________________________________。
|
 五、(本题包括2小题,共22分)
五、(本题包括2小题,共22分)18.(14分)目前,我国的能源结构主要是煤,还有石油、天然气、核能等,这些能源都是一次不可再生且污染环境的能源,研究和开发清洁而又用之不竭的能源是未来发展的首要任务。科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量。
即:H2(气)十1/2 O2(气)→H2O(液)+285.5kJ/mol
(1)试分析为什么“氢能”将是未来21世纪最理想的新能源?(指出两点优点即可)
,
(2)目前世界上的氢绝大部分是从石油、煤炭和天然气中制取。请写出工业上由天然气制氢气的化学反应方程式。
(3)利用硫-碘热循环法制取氢也是化学家常用的一种方法,总反应方程式为2H2O
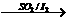 2H2+O2,其循环过程分三步进行:
2H2+O2,其循环过程分三步进行:
(a) SO2+I2+H2O→A+B
(b) A→?+?
(c) B→?+?+?
①完成以上三步反应,并确定哪步反应最难进行。
②请对硫-碘热循环法制取氢的优劣和前景作一分析。
(4)目前,氢总量只有4%左右由电解水的方法制取。
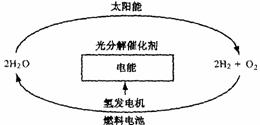 电解水法制氢一方面消耗的电能比氢能释放的能量还要高,另一方面电能本身就是高效、清洁能源,以电能换氢能,成本很高,显然消耗电能来获得氢能的方法是得不偿失。请问用什么方法可以降低电解法制氢的成本。
电解水法制氢一方面消耗的电能比氢能释放的能量还要高,另一方面电能本身就是高效、清洁能源,以电能换氢能,成本很高,显然消耗电能来获得氢能的方法是得不偿失。请问用什么方法可以降低电解法制氢的成本。
(5)目前,有人提出一种最经济最理想的获得氢能源的循环体系,如右图所示:
这是一种最理想的氢能源循环体系,类似于生物的光合作用,太阳能和水是用之不竭,而且价格低廉。急需化学家研究的是
(6)列举两种方法简单安全地输送氢气。
17.(14分)某化学兴趣小组的同学利用下图装置制取 并完成下列反应的实验:
并完成下列反应的实验:
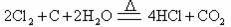
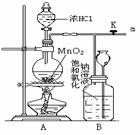
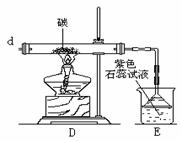
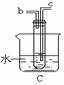
(1)A为氯气发生装置,写出反应的化学方程式 ;
(2)要将C装置接入B和D之间,正确的接法是:a → → → d ;
(3)实验开始先点燃A处的酒精灯,打开旋塞K,让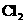 充满整个装置,再点燃D处的酒精灯。
充满整个装置,再点燃D处的酒精灯。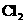 通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成
通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成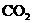 和HCl(g),装置C的作用是______________________ ;
和HCl(g),装置C的作用是______________________ ;
为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是 ;
下列物质中可用于代替浓硫酸发挥应有作用是 (填序号);
A.硝酸铵 B.生石灰 C.氢氧化钠 D.氯化钠
(4)反应开始后进入E处的气体有 ,观察到E处石蕊试液发生的变化是 ;发生反应的化学方程式是 ;
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量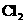 产生,此时B中的现象是__
,B的作用是_
;
产生,此时B中的现象是__
,B的作用是_
;
(6)为证明生成物中含有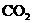 ,甲同学设想将以上E装置中紫色石蕊液改为澄清石灰水,并根据澄清石灰水是否变浑浊,可证明生成物中是否含有
,甲同学设想将以上E装置中紫色石蕊液改为澄清石灰水,并根据澄清石灰水是否变浑浊,可证明生成物中是否含有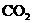 ,你认为合理吗
(“合理”、“不合理”);说明理由:
,你认为合理吗
(“合理”、“不合理”);说明理由:
。
16.(6分)现需要纯净的氯化钠溶液,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠。现有如下设计方案:
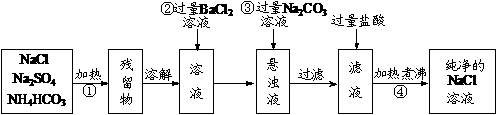
(1)操作①可选择的主要仪器是________________、________________仪器。
(2)操作②不用硝酸钡溶液的理由是____________________________________。
(3)操作④的目的是__________________________________________________。
15.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
|
|
被提纯的物质 |
除杂试剂 |
分离方法 |
|
A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
|
B |
氯化铵溶液(FeCl3) |
氢氧化钠溶液 |
过滤 |
|
C |
二氧化碳(CO) |
氧化铜粉末 |
通过灼热的CuO粉末 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
第Ⅱ卷(非选择题 共90分)
14. m g的焦炭与X g的O2置于密闭容器中,在一定条件下充分反应后恢复到原来的温度,容器中反应物均无剩余。设反应前后压强分别为P1、P2,以下说法正确的是
A.如果P1=P2,m≤3X/8
B.如果2P1=P2,m≥3X/4
C.如果P1<P2<2P1,3x/4 > m> 3x/8
D.无论前后压强如何变化,m=3X/8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com