
题目列表(包括答案和解析)
2.有文献报道,硫在空气中燃烧时,产物中SO3约占5% - 6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2% - 3%,解释这一事实的理由正确的是
A.在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动
B.在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动
C.在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响
D.没有使用催化剂
1.2005年诺贝尔化学奖被授予“在烯烃复分解反应研究方面作出贡献”的三位科学家。“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程。如2分子烯烃RCH=CHR'用上述催化剂作用会生成两种新的烯烃RCH=CHR和R'CH=CHR',反应式可表示为:2RCH=CHR'-→ RCH=CHR + R'CH=CHR'
现有结构简式为CH2=CHCH3和CH2=C(CH3)2的两种烯烃,发生上述的“烯烃复分解反应”,能生成多种新的烯烃。下列说法正确的是
A.生成的新烯烃共有5种
B.生成的各种新烯烃中,每个烯烃分子与HCl加成后,都只能生成一种产物
C.生成的所有新烯烃分子中,每个分子中的碳原子均共面
D.生成的所有新烯烃分子中,只有两种新烯烃分子中的碳原子共面
24.(10分)取一定质量的NaBr、NaI的混合物平均分成五等份,分别加水配成溶液并编号为甲、乙、丙、丁、戊再分别向各溶液中通入一定体积的氯气,将反应后所得溶液蒸干灼烧得固体,通入氯气的体积与最终所得的固体质量记录如下:
|
编号 |
甲 |
乙 |
丙 |
丁 |
戊 |
|
固体组成 |
|
|
|
|
|
|
Cl2的体积/ml |
V |
2V |
3V |
4V |
5V |
|
固体的质量/g |
54.62 |
43.64 |
35.48 |
30.14 |
29.25 |
求:(1)填写表中空白:
(2)标准状况下Cl2的体积V为 ,原混合物中NaBr的物质的量为
25.(10分)含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO3-还原为N2,从而消除污染。其反应的离子方程式是:
6NO3-+ 10Al + 18H2O=3N2↑+ 10Al(OH)3 + 6OH-。
某化学兴趣小组的同学经过探究发现还有两条途径:
⑴金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。金属镁是从海水中提取的MgCl2通过电解制得的。若要除去1m3含氮元素0.3mol的废水中的NO3-,则至少需要含0.5%(质量分数)MgCl2的海水多少kg?
⑵甲醇加人含NO3-的废水中也可消除氮的污染,其在一种微生物作用下发生反应:
6NO3- +6H+ +5CH3OH → 3N2↑ + 5CO2 ↑+ 13H2O
若某废水用上述方法处理时, NO3-→N2的转化率为a%,那么每天处理此含NO3-为b g/L的废水V m3 (密度1g/cm3) 。需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
24.(10分)以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。

请按要求填空:
⑴写出下列反应的反应类型:
反应①________________,反应⑤________________,反应⑧________________。
⑵反应②的化学方程式是______________________________________________。
⑶反应③、④中有一反应是与HCl加成,该反应是________(填反应编号),设计这一步反应的目的是__________________________________________________,物质C的结构简式是_______________________。
23.(8分)现有A、B两种有机化合物,已知:
①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;
②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③它们都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官 能团不直接与苯环相连,C的结构简式是________________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有 两种,D的结构简式是__________________________。
19.(10分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。

⑴若A为黄色固体,C能使品红试液褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则①工业上反应Ⅰ在_______________中进行,反应Ⅲ在_______________(均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是___________或_____________。
③反应Ⅰ的化学方程式是__________________________。
⑵若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①甲的电子式是____________。
②D的溶液与乙反应的离子方程式是__________________________________。
③若1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式:___________________________________________________________________。
18.(12分)铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的,位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中其中+3较为稳定。我校化学兴趣小组对铬的化合物进行探究性研究。
(1)Cr2O3微溶于水,与Al2O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其电离方程式是: 。
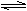 (2)工业上和实验室中常见的铬(+6价)化合物是其含氧酸盐,如铬酸盐和重铬酸盐,以K2Cr2O7和Na2Cr2O7最为重要。在K2Cr2O7溶液中存在着Cr2O72-与CrO42-,并达到以下平衡: Cr2O72-+H2O 2 CrO42-+2H+
(2)工业上和实验室中常见的铬(+6价)化合物是其含氧酸盐,如铬酸盐和重铬酸盐,以K2Cr2O7和Na2Cr2O7最为重要。在K2Cr2O7溶液中存在着Cr2O72-与CrO42-,并达到以下平衡: Cr2O72-+H2O 2 CrO42-+2H+
(橙红色) (黄色)
当H+浓度增大时,平衡向生成 方向移动,溶液呈 色;当OH-浓度增大时,则因消耗H+,会使平衡向生成 方向移动,溶液呈 色。
工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,使废水中的铬含量达排放标准。
①在装置中应该用 (填材料名称)做电解池的阳极,阴极上电极反应方程式是 。
②Cr2O72- 在酸性条件下有强氧化性,试写出Cr2O72-转变成Cr3+的离子方程式。
。
(3)在试管中加入3mL硫酸酸化的K2Cr2O7溶液然后向其中滴加乙醇,可观察到橙红色褪去,变为绿色。重铬酸钾可被乙醇还原,写出其化学反应方程式:
。
17.(14分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I]
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II]
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液 mL,用C′mol/L
NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L
NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯、药匙、锥形瓶之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III]
(1)称取碳酸钙样品 M g;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?
________________________________________________________________________
问题2:本方案中的“冷却”应如何操作,为什么?
________________________________________________________________________
[方案IV]
(1)称取碳酸钙样品 M g;
(2)加入足量Cmol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钠纯度将
(偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案 ; 。
方案 ; 。
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com