
题目列表(包括答案和解析)
22.(12分)2005年的诺贝尔化学奖颁给了3位在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解反应实际上是在金属烯烃络合物的催化下实现C=C双键两边基团换位的反应。如下图表示了两个丙烯分子进行烯烃换位,生成两个新的烯烃分子--丁烯和乙烯。

现以石油裂解得到的丙烯为原料,经过下列反应可以分别合成重要的化工原料I和G。I和G在不同条件下反应可生成多种化工产品,如环酯J。
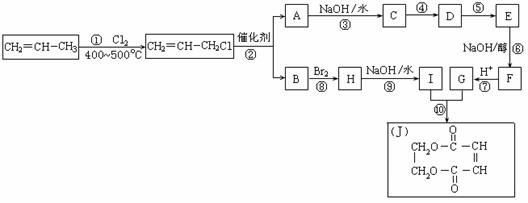
请按要求填空:
(1)写出下列反应的反应类型:
①:______________,⑥:______________,⑧:______________。
(2)反应②的化学方程式是___________________________________________。
(3)反应④、⑤中有一反应是与HCl加成,该反应是________(填反应编号),
设计这一步反应的目的是__________________________________________ _,
物质E的结构简式是______________ _________。
(4)反应⑩的化学方程式是________________________________________ ___。
21.(12分)A、B、C、D、E、F、G、H均为含有苯环的有机物。B与FeCl3溶液混合没有颜色变化,F、H除苯环外还有一个含氧的六元环(与苯环共用2个碳原子)。它们之间的转化关系如下:
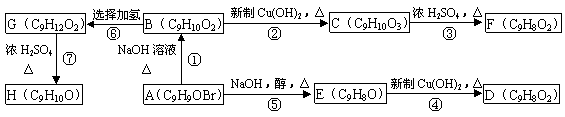
(1)化合物A含有的官能团是 。
(2)B、F的结构简式分别为 、 。
(3)物质D不可能具有的性质是 (填写字母)。
A.使溴水褪色 B.使酸性KMnO4溶液褪色 C.能与Na2CO3溶液反应
D.能发生酯化反应 E.能与新制的Cu(OH)2反应 F.能使FeCl3溶液变色
(4)反应⑤的反应类型是 。
(5)写出反应①的化学方程式: 。
(6)写出同时符合下列两项要求的C的两种同分异构体的结构简式
①化合物是1,3,5-三取代苯 ②苯环上的三个取代基中必须含有醇羟基、酚羟基和醛基这三种结构
。
20.(6分)化合物A俗称“吊白块”,年产量上万吨,主要用于染色工艺,具还原性和漂白性,对热不稳定,有毒。近年报道,我国一些不法商人违章地将A添加到米、面、腐竹、食糖等食品中增白,导致多起严重食物中毒事件,如某地曾发生五所学校400余名学生食用含A食品一次性中毒事件。已知:
①固体A·2H2O的摩尔质量为154g/mol;
②A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
③ A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
④ A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1︰1),反应产物为A和亚硫酸钠。
⑤A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式。
(2)写出上述制备A的“分子方程式”。
19.(12分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
 (2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
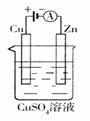
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼
一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
18. (10分)现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,D、E同主族,A、B的最外层电子数之和与C的最外层电子数相等,A、C、D的质子数之和与E的原子序数相等, A能分别与B、C 、D形成电子总数相等的分子。D、E均能形成多种同素异形体。
(10分)现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,D、E同主族,A、B的最外层电子数之和与C的最外层电子数相等,A、C、D的质子数之和与E的原子序数相等, A能分别与B、C 、D形成电子总数相等的分子。D、E均能形成多种同素异形体。
请回答:
⑴D和E的氢化物中,沸点较低的是 (写氢化物分子式)。
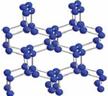
⑵下图为C元素的某种单质的晶体片段结构图,该晶体中每个C原子都通过三个单键与其它C原子结合并向空间发展构成立体网状结构。则该晶体属于 晶体(填原子、分子、离子等),该晶体中原子个数与共价键数之比为 。
⑶甲、乙两种盐中都含有A、B、C、D四种元素,甲盐中A、B、C、D四种元素的原子个数比为4∶1∶1∶2,将一定量的晶体物质甲,放在真空的密闭容器中加热到200℃时,甲全部分解为4种气体,其中四种气体的物质的量之比为2﹕1﹕1﹕1。若再冷却容器到一定温度时,又发现有晶体物质乙生成,此时容器中只剩一种气体,该气体未参加反应,已知该气体在相同条件下相对于氢气的相对密度为14,而且能够在空气中燃烧。
则甲的化学式为 ,乙的化学式 。
甲分解的化学方程式为 。
17.(10分)已知甲酸和浓硫酸共热到60~80℃可发生脱水反应:
|
HCOOH────→ CO↑+H2O
 实验室用甲酸和浓硫酸混和后制取CO时,常不需加热,其具体操作方法如下:在试管内倒入一定体积的甲酸,然后再小心沿试管壁倒入等体积的浓硫酸,这时可见试管内液体分上、下两层,在两层液体的界面处有少量气泡,轻轻振动试管,可见液体交界面气泡增多,改变振动的力度可控制气泡产生的速率。试回答下列问题
实验室用甲酸和浓硫酸混和后制取CO时,常不需加热,其具体操作方法如下:在试管内倒入一定体积的甲酸,然后再小心沿试管壁倒入等体积的浓硫酸,这时可见试管内液体分上、下两层,在两层液体的界面处有少量气泡,轻轻振动试管,可见液体交界面气泡增多,改变振动的力度可控制气泡产生的速率。试回答下列问题
⑴用该法制CO不需加热的原因: 。
⑵以上操作方法可控制反应速率的原因: 。
⑶具支试管(试管侧壁有一支管,如右图所示)在实验室有多种用途,试只用具支试管、橡皮塞(橡皮塞上最多只能打一个孔)、玻璃导管及连接和夹持仪器装配一个用浓硫酸和甲酸的混合液制取CO气体,用CO还原氧化铜,并检验其氧化产物的实验装置。画出该装置示意图(同类仪器最多只有三件,不必画夹持仪器,但需注明所装的药品)
16.(8分)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光.回答下列问题:
⑴有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确? 说明理由。
⑵通过挤压,使过氧化氢与草酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高粘度的有机化合物)
⑶在设计魔棒时,其连续发光的能力在8-12h,如果在发光中途,把它放入冰箱的冷冻室中,发光便会停止或基本停止.把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因是什么?
15.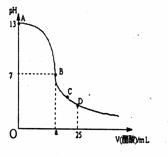 在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,
在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,
曲线如下图所示,有关粒子浓度关系比较正确的
A.在A、B间任一点,溶液中一定都有:
c(Na+) > c(CH3COO-) > c(OH-) > c(H+)
B.在B点,a>12.5,且有:c(Na+) = c(CH3COO-) > c(OH-) = c(H+)
C.在C点:c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.在D点:c(CH3COO-) + c(CH3COOH) == c(Na+)
第Ⅱ卷(非选择题 共90分)
14.商品锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极反应为:
负极:C6+Li++e-→LiC6
正极:Li0.5CoO2+0.5Li++0.5e-→
LiCoO2表示锂离子电池的总反应式为: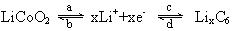 其中表示充电过程的是
其中表示充电过程的是
A.ac B.ad C.bc D.bd
13.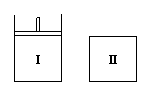 如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?) + Y(?)
如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入2molX和2molY,起始时容器体积均为VL,发生如下反应并达到平衡(X、Y状态未知):2X(?) + Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1∶3∶2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于VL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com