
题目列表(包括答案和解析)
18.(12分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。如H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。一个化学反应一般都有旧化学键的破坏和新化学键的形成。
下表是一些键能数据(KJ·mol-1):
|
|
键能 |
|
键能 |
|
键能 |
|
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
H-O |
464 |
|
S=S |
255 |
H-S |
339 |
C-F |
427 |
C-O |
347 |
|
C-Cl |
330 |
C-I |
218 |
H-F |
565 |
|
|
回答下列问题:
(1)由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。能否从数据找出一些规律,请写出一条:___________________________________;试预测C-Br键的键能范围_________<C-Br键能<__________。
(2)由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ·mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是_____________________________________________________,由热化学方程式2H2(g)+S2(s) →2H2S(g);△H=-224.5KJ·mol-1和表中数值可计算出1mol S2(s)气化时将________(填“吸收”或“放出”)_______KJ的热量。
(3)卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是_________________________________。
17.(14分)目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO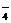 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO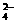 。
。
为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
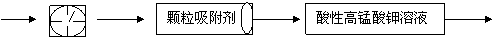


 ①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过

 气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。
气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒; 表示气体的流向。
②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
回答下列问题:
(1)配制200mL0.1mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有 、玻璃棒、 、 、 。玻璃棒的作用是 。
(2)写出并配平测定SO2含量的离子方程式:_______________________ _
(3)若气体流速管中气体流速为a cm3/min,当t min时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为 (g/cm3)。
(4)实验中棉花的作用是______________________________________________;
若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是
。
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):
_______________________________________________________________。
16.(13分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯
气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
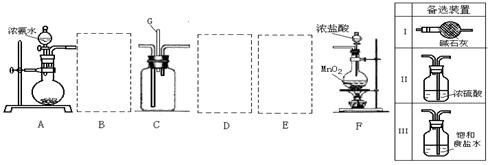
请回答下列问题:
(1)装置F中发生反应的离子方程式 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择。并将编号填入下列空格。
B__________、D__________、E__________(填编号)
(4)氯气和氨气在常温下相混就会反应生成氯化铵和氮气,该反应的化学方程式为: ;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:
。
(5)从装置C的q处逸出的尾气可能含有污染环境的气体,如何处理?
答: 。
15.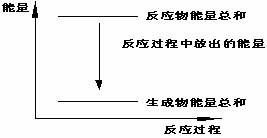 对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时, 正极放出气体一定为11.2L
第Ⅱ卷(非选择题 共90分)
14.下列关于铁及其化合物的说法中,正确的是
A. Fe和Cu以及浓硝酸组成的原电池,Fe是原电池的负极
B. 将镁粉加入FeCl3溶液中有大量的气泡和红褐色沉淀产生
C.室温下将小铁片放入浓硝酸一段时间,取出洗净后再放入CuSO4溶液中,表面有红色物质析出
D.反应Al3++3AlO2-+6H2O=4Al(OH)3↓不属于化合反应
13. 向含0.1mol的AlCl3溶液中分别加入15mL或者45mL烧碱溶液时,生成沉淀的质量相等,则NaOH溶液的物质的量浓度(单位:mol/L)为
A.5 B.6 C.7 D.8
12.某元素X的相对原子质量为a,它的最高价氧化物的水化物的分子式为HmXOn(m>1),下列叙述一定正确的是
A.该酸水溶液中c(H+)︰c(XOnm-)=m︰1
B. 该酸的摩尔质量为(m+a+16n)g
C. 若n=m=3时,1mol该酸最多能与含3molNaOH的溶液反应
D. 若0.1mol/L该酸溶液的pH=2,则NamXOn水溶液的pH>7
11.下列说法正确的是
A.在熔化状态下NaHSO4的电离方程式是:NaHSO4=Na++H++SO42-
B.混合两种弱酸或者两种弱碱有可能生成强电解质
C.向平衡体系FeCl3+3KSCN Fe(SCN)3+3KCl中加入KCl固体,红色变浅
Fe(SCN)3+3KCl中加入KCl固体,红色变浅
D.把桌面上直立的两支高低不等的小蜡烛点燃后再倒扣一只大烧杯,燃烧一段时间后,低的那支蜡烛先熄灭
10.某学生在实验室里做气体的性质实验时,欲根据气体通入某一种物质水溶液中出现的现象作推断,其中正确的是
A.先有沉淀产生,后沉淀溶解,则该气体一定是SO2或CO2
B.先无明显现象,放置一段时间后有沉淀产生,则该气体可能为SO2或H2S
C.溶液pH值先降低,当达到7时,再通气体pH值不再降低,该气体一定为氧气
D.溶液pH先升高,后又降低到某一数值后不再降低,则该气体一定为SO2
9.下列说法正确的是
A.苯酚不但比乙醇更难被氧化剂所氧化,而且苯酚比乙醇更容易发生酯化反应
B.两种不同氨基酸反应后形成的二肽只有三种
C.石油是各种烷烃、烯烃、炔烃组成的混合物
D.邻二甲苯只有一种结构,说明苯分子中不存在实际上的C-C键和C=C键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com