
题目列表(包括答案和解析)
1、实验原理:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
x元酸和y元碱恰好中和时
xc酸V酸=yc碱V碱
3、注意事项
(1)称前研细(2)小火加热(3)在干燥器中冷却
(4)不能用试管代替坩埚(5)加热要充分但不“过头”(否则CuSO4 也会分解)
2、实验步骤--“四称”、“两热”
(1)称坩埚(W1 g)
(2)称坩埚及晶体的质量(W2 g)
(3)加热至晶体完全变白
(4)冷却称重(W3 g)
(5)再加热
(6)冷却称重(两次称量误差不得超过0.1g )
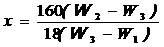 (7 ) 计算(设分子式为CuSO4·x H2O )
(7 ) 计算(设分子式为CuSO4·x H2O )
1、实验原理
硫酸铜晶体是一种比较稳定的结晶水合物,当加热到258℃左右结晶水全部失去,据加热前后的质量差,可推算出其晶体的结晶水含量。
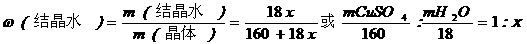 设硫酸铜晶体为CuSO4·x H2O
设硫酸铜晶体为CuSO4·x H2O
24.(10分)电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板制成印刷线路板。现有400ml某FeCl3溶液A作为铜箔的腐蚀液,反应一段时间后,向所得溶液B中加入ag铁粉,充分反应后剩余bg固体。从滤液C中取出20.00ml(假设反应前后溶液体积不变),向其中滴入3.000mol· AgNO3溶液60.00ml时,溶液中的Cl- 恰好完全沉淀。
AgNO3溶液60.00ml时,溶液中的Cl- 恰好完全沉淀。
(1)溶液A中FeCl3 的物质的量浓度为 。
(2)若向溶液B中加入铁粉后,滤液C中既含有Fe2+ 又含有Cu2+且不含Fe3+ ,则 _________(填编号)
①只有Fe剩余 ②只有Cu剩余 ③既有Fe又有Cu剩余 ④既无Fe又无Cu剩余
(3)溶液B最多可溶解铁粉的质量为 。
(4)若残留固体只有Cu,则b的取值范围是 。
(5)当a=60,b=40时,试通过计算确定剩余固体的成分及各成分的质量。写出计算过程。
23. (9分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
(9分)将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。
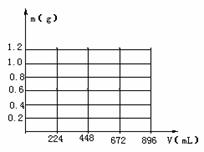
(1)当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL。
①在图示坐标系中,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系图象。
②图示坐标系中,生成沉淀的最大质量是 ,沉淀恰好全部溶解时消耗CO2体积为 mL。
③原混合物中KOH的质量为 g。
(2)若KOH和Ca(OH)2以任意比例混合,总质量仍然保持1.3g不变,则消耗CO2总体积V的取值范围为(取整数) 。
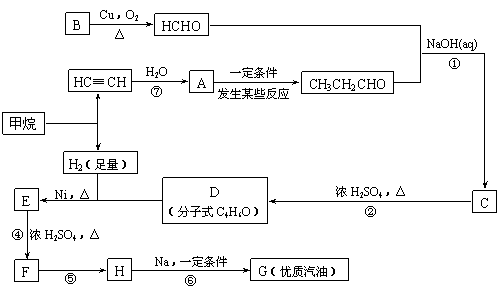
22.(12分)2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展、人口增多,对能源的需求量逐年增加,全球石油储量下降。寻求和制备代号称“黑金”的新能源已经成为紧迫任务,化学工作者正在研究以天然气和醇类合成优质汽油的方法。
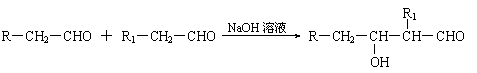 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
(1)
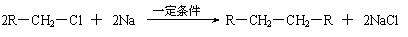
⑵
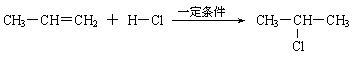
 ⑶
⑶
合成路线如下:
⑴在反应②-⑦中,属于加成反应的是 ,属于消去反应的是 。
⑵写出下列反应方程式
E → F: ;
H → G: 。
⑶H也能与NaOH溶液反应,其反应方程式为 ,生成的有机物能否在Cu或Ag作催化剂的条件下被空气氧化 (选填“能”或“否”)。
21.(9分)乙烯利是目前农业生产中普遍使用的植物生长调节剂,对促进橡胶、蔬菜、水果、棉花等的早熟均具有非常好的效果。乙烯利的工业生产是用乙烯等为原料经下列步骤进行的(其中乙烯转化为氯代乙醇有图示的两种途径):
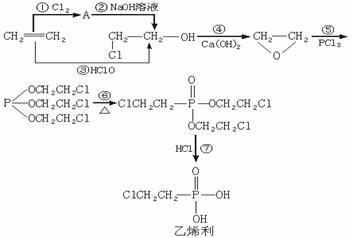
请回答下列问题:
(1)有机化学的基本反应类型有:A.加成反应 B.消去反应 C.取代反应 D.重排反应四种。其中重排反应是指像CH2=CH-OH
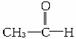 的一类反应,即反应的过程只是原子在分子内的结合方式发生重新排列。请指出合成路线中下列反应所属的基本类型(填代号):③___________,⑥__________,⑦__________。
的一类反应,即反应的过程只是原子在分子内的结合方式发生重新排列。请指出合成路线中下列反应所属的基本类型(填代号):③___________,⑥__________,⑦__________。
(2)写出反应方程式:① ;
⑤ 。
(3)乙烯利的制取过程较好地体现了绿色化学的两个特征:原料的原子利用率高(原料中的原子尽可能多地转化到产品中),不向或少向环境中遗留副产物。如上述过程中的有机副产物(写结构简式)_______________就可以在该合成中重复利用。
20.(9分)1991年Langmuir提出:“凡原子数与总电子数相等的物质,则结构相同,物理性质相近”,称为等电子原理。相应的物质,互称为等电子体.化学科学家常用“等电子体”来预测不同物质的结构与性质,例如CH4与NH4+ 有相同的电子数目及空间构形.
(1)依据等电子原理在下表空格处填写相应的化学式:
|
CH4 |
|
CO32- |
|
C2O42-
|
|
N3B3H6 |
|
NH4+ |
N2H62+ |
|
NO2+ |
|
N2 |
|
(2)(BN) 3 是一种新的无机合成材料,它与某单质互为等电子体.工业上制造(BN) 3的方法之一是用硼砂(Na2B4O7)和尿素在1073-1273K时反应,得到α-(BN)3 及其它元素的氧化物.α-(BN)3可作高温润滑剂、电气材料和耐热的涂层材料等。如在高温高压条件下反应,可制得β-(BN)3,β-(BN)3 硬度特高,是作超高温耐热陶瓷材料、磨料、精密刃具的好材质.
①它与什么单质互为等电子体 ;
②写出硼砂和尿素的反应方式 ;
19.(12分)物质A是化合物,B、C、D、K都是单质,反应②-⑤都是常见的工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
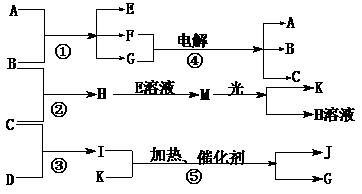
请填写下列空白:
(1)写出下列物质的化学式:B ; C ; D ;
K ;G ;J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com