
题目列表(包括答案和解析)
3.限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应符合离子方程式2H++SO32-=H2O+SO2的化学方程式个数有
A.4 B.5 C.8 D.12
2.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g);△H=-283kJ/mol
1.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是
A.用氯气和消石灰制漂白粉 B.铝热法冶炼金属钒
C.用油脂制肥皂 D.电解饱和食盐水制烧碱
4、HCl、NH3 等气体经喷泉实验所得溶液浓度的无数据巧算方法:令气体体积(标准状况)为1L(不论是否充满烧瓶),喷泉后溶液体积亦为1L,故C为恒值:1/22.4mol/L≈0.045mol/L;但w则不为恒值,可根据气体摩尔质量、溶液密度(视为1g/mL)求算。
例题精析
[例1]设NA为阿伏加德罗常数,下列关于 0.2mol/L的Ba(NO3)2 溶液正确的说法是( )
A 2L溶液中有阴、阳离子总数为0.8NA
B 500mL溶液中NO3_离子浓度为0.2mol/L
C 500mL溶液中Ba2+离子浓度为0.2mol/L
D 500mL溶液中含NO3― 离子总数为0.4NA
[例2]在标准状况下,1体积水溶解700体积NH3 ,所得溶液密度为0.9g/cm3,则此氨水的物质的量浓度为 ( )
A 18.4mol/L B 34.7% C 20.4mol/L D 31.2%
★虽然氨水中的主要溶质是NH3·H2O,但有关质量分数及浓度计算均以NH3计算。
[例3]将14%的KOH溶液加热蒸发掉100g水后,变成80mL28%的KOH溶液,则此时溶液的物质的量浓度为( )
A 6mol/L B 6.25mol/L C 3.5mol/L D 7mol/L
建议:近年的高考化学中计算题的失分主要是在计算,建议计算过程中一律在小数点后保留一位小数(除非题中有有效数字取舍的强调或暗示),平时少用计算器。
[例4]标准状况下,用一定量的水吸收氨气后制得浓度为12mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水(水的密度以1.00g/cm3)?
[备选例题]超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3 +N2 +3C 2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验:
2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验:
(1) 称取10.00g样品,将其加入过量的NaOH 浓溶液中共热并蒸干,AlN跟NaOH 溶液反应生成NaAlO2 ,并放出氨气3.36L(标准状况).
① 上述反应的化学方程式为______________________________________________.
② 该样品中的AlN的质量分数为____________________
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应)。该样品中杂质炭 g。
3、 溶液稀释或混合的计算:
(1)可根据稀释前后,溶液中溶质的物质的量不变的公式,c1V1=c2V2或溶质的质量不变的公式,V1·ρ1·w1= V2·ρ2·w2= V1·c1·M= V2·c2·M计算有关的量。
(2)同种溶质(或含同种离子)的溶液混合,可根据混合前后溶质(或离子)的物质的量之和不变列式计算。稀释(或混合)前的溶液与水(或另一浓度的溶液)的质量可以相加。但是,体积一般不可以相加,而应运用m(后)/ρ(后)算出。只有稀释(或相互混合)且题中未给出稀释(或混合)后溶液的密度或密度变化较小时,才可忽略稀释(或混合)后的体积变化,将二者体积直接相加。
2、 溶液中溶质的质量分数与物质的量浓度之间的换算,溶液的密度是必不可少的条件。将质量分数换算成物质的量浓度时,可运用n=V·ρ·w/M算出1000mL溶液中所含溶质的物质的量。将物质的量浓度换算成质量分数时,可从1L溶液出发,运用
w= 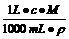 直接计算。
直接计算。
1、 关于物质的量浓度的计算主要包括:
(1) 溶质的质量、溶液的体积和物质的量浓度之间的计算。可运用公式:n=m/M,c=n/V或运用“倍数关系”算出1L溶液所含溶质的物质的量。
(2) 已知气体溶质的体积(标准状况下)、水的体积和溶液的密度,计算溶液的密度,计算溶液中的溶质的物质的量浓度。应先运用n=V/22.4L/mol,求出溶质的物质的量,运用V=m/ρ(液) 求出溶液的体积.
(3) 计算溶液中的离子浓度,还要根据溶质的电离方程式,算出离子的物质的量。
4、 物质的量浓度溶液的配制
(1) 计算:所需固体的质量或浓溶液的体积(小数点后保留一位小数)。
(2) 称:用天平。注意NaOH 等易潮解和腐蚀性的物质要放在小烧杯中迅速称量。
量:用量筒或滴管,注意规格。
(3) 溶解:在烧杯中进行。注意烧杯规格与所配溶液体积相近,加水量为所配溶液体积的一半。
(4) 移液:在冷却后进行,注意容量瓶规格。
(5) 洗涤:洗涤烧杯、玻璃棒2~3次,一起注入容量瓶中,并轻轻摇动容量瓶,再加水至近刻度1~2cm处。
(6) 定容:注意定容后摇匀(此时液面有可能低于刻度线,那是在瓶塞处损耗之故,无需再定容)。
巧思巧解
3、 气体相对分子质量的计算
(1) 已知标准状况下气体密度ρ,M=22.4ρ
(2) 已知气体A对气体B的相对密度d,MA=dMB
(3) 已知混合气体的平均相对分子质量为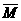 ,
,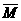 =m总/n总
=m总/n总
(式中m总是气体混合物的总质量,n总是混合气体的总物质的量)
(4)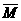 =M1w1+M2w2+……
=M1w1+M2w2+……
如M(空气)=28×78%+32×21%+40×0.94%+44×0.03%+18×0.03%=28.96
2、 阿伏加德罗定律及推论
|
条件 |
结论 |
文字 |
|
T、P相同 |
 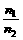 = =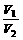 |
同温同压下,气体的分子数与其体积成正比 |
|
T、V相同 |
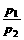 = =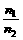 |
温度、体积相同的气体,压强与其分子数成正比 |
|
T、P相同 |
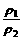 = = |
同温同压下,气体的密度与其相对分子质量成正比 |
|
T、P、V相同 |
 = =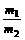 |
同温同压下,体积相同的气体,相对分子质量与其质量成正比 |
|
T、P、m相同 |
 = =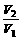 |
同温同压下,等质量的气体相对分子质量与其体积成反比 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com