
题目列表(包括答案和解析)
6.下列各组物质只用一种试剂即可鉴别的是…………………………………………( )
A.CH3CH2OH、 CH2=CHCOOH、 CH3CHO、 CH3COOH
B.苯酚溶液、淀粉KI溶液、乙酸溶液、氢氧化钾溶液
C.裂化汽油、乙酸、甲苯、溴苯、烧碱
D.乙烯、甲醛、乙炔、甲烷、裂解气
5.下列反应的离子方程式正确的是……………………………………………………( )
A.将氢碘酸加到Fe(OH)3胶体中:Fe (OH)3 +3H+ŽFe3++3H2O
B.碳酸氢钙溶液中加入少量烧碱溶液:Ca2++HCO3-+OH-ŽCaCO3↓+H2O
C.新制氯水中滴入少量溴化亚铁溶液:2Fe2++4Br-+3Cl2Ž2Fe3++2Br2+6 Cl-
D.锌与1 mol/L HNO3溶液反应:Zn +2H+ Ž Zn2+ + H2↑
4.C1SO3H称为氯磺酸,是一种强酸。对于反应:ClSO3H+HCOOH→CO+HCl+H2SO4有如下判断,其中较合理的是…………………………………………………………( )
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值增大 D.反应后溶液的pH值变小
3.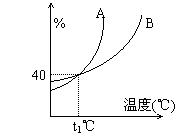 A、B两种物质的饱和溶液的质量分数随温度变化的曲线如图。 现分别在50g A和80 g B中各加水150 g,加热溶解后并都蒸发掉水50 g ,冷却到t1℃,下列叙述正确的是
A、B两种物质的饱和溶液的质量分数随温度变化的曲线如图。 现分别在50g A和80 g B中各加水150 g,加热溶解后并都蒸发掉水50 g ,冷却到t1℃,下列叙述正确的是
A. t1℃时溶液中A、B的质量分数相等
B. t1℃时溶液中A的浓度小于B的浓度
C. t1℃时析出固体B
D. t1℃时两者均无固体析出
2.碘是卤素中原子半径较大的元素,可能呈现金属性。下列最能说明该结论的是( )
A.已经制得了IBr、ICl等卤素互化物
B.已经制得I2O5等碘的氧化物
C.已经制得了I(NO3)3、I(ClO4)3·2H2O等含I 3+离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3-离子
1.运用元素周期律分析下面的推断,其中错误的是 ( )
A.铍的氧化物的水化物可能有两性
B.单质砹为有色固体;HAt不稳定;AgAt感光性很强,不溶于水也不溶于稀硝酸
C.硫酸锶是难溶于水的固体
D.硒化氢是无色、有毒、比H2S稳定的气体
12.下表是元素周期表中第一、第二周期10种元素的某种性质的一组数据(所列数据的单位是相同的)。除带“……”的四种元素除外,其余元素都给出了该种元素的全部该类数据。
|
(H) 13.6 |
|
|
|
|
|
|
(He) 24.6 54.4 |
|
(Li) 5.4 75.6 122.5 |
(Be) 9.3 18.2 153.9 217.7 |
(B) 8.3 25.2 37.9 259.4 340.2 |
(C) 11.3 24.4 47.9 64.5 392.1 489.9 |
(N) 14.5 29.6 47.4 72.5 97.9 552.1 …… |
(O) 13.6 35.1 …… …… …… …… …… …… |
(F) 17.4 34.9 …… …… …… …… …… …… …… |
(Ne) 21.6 41.6 …… …… …… …… …… …… …… …… |
研究这些数据:
(1)每组数据可能是该元素的( )
(A)原子得到电子所放出的能量 (B)原子半径的大小
(C)原子逐个失去电子所吸收的能量 (D)原子及形成不同分子的半径的大小
(2)分析同周期自左往右各元素原子的第一个数据
①总体变化趋势是_______(填“增大”或“减小”),②与前后元素相比,由于该元素的数值增大得较多而变为反常的元素是在________族,分析它们的原子核外电子排布后,指出造成上述反常情况的可能原因是( )
(A)它们的原子半径突然变小些 (B)它们的核外电子排布处于饱和状态
(C)它们的原子半径突然变大些
(D)它们的核外电子排布处于半充满或全充满状态
根据以上规律,请推测镁和铝的第一个数据的大小Mg(1)_____Al(1)
(3)同一元素原子的一组数据是约以倍比关系增大,请你说出可能的一个原因是_________________________________________________,每个元素的一组数据中个别地方增大的比例特别大,形成突跃(大幅度增大),请找出这些数据,并根据这些数据出现的规律,你认为氧元素出现该情况的数据应该是氧元素8个数据的第_______个。
上述规律可以证明原子结构中_______________________________的结论。
停课期间
每日一餐(二)
11.在元素周期表中,相邻近的元素在结构和性质上有许多相似之处。
(1)第二周期的碳、氮、氧、氟都可以形成氢化物,氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6等;与之相似的氮元素的氢化物除NH3外,还有________(填化学式),其沸点比液氨____(填“高”或“低”),稳定性比氨_____( 填“好”或“差”),该氢化物与足量盐酸反应的化学方程式为__________________。
(2)氮原子间也可形成链状结构,假设氮原子间只以N-N键形式连接,并形成氢化物,则该系列氢化物的通式为___________________。
(3)1998年,美国科学家卡尔·克里斯特合成了具有高能量的正离子N5+是一种“V”字形的结构,在N5+中每个氮原子最外层都满足“8电子稳定结构”,整个结构中含有两个N≡N键,推测N5+离子的结构式为:_____________________________。
10.制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油,②溶解FeSO4配成溶液,③把蒸馏水加热煮沸并密封冷却,④加入少量铁屑,⑤加入少量CCl4,⑥向FeSO4溶液中滴入足量氨水,⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。其中必须进行的操作及其正确顺序是 ( )
A.③②④①⑦ B.③②⑤⑥④ C. ③②④⑤⑦ D.②④①⑦⑤
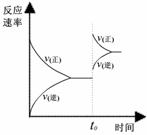
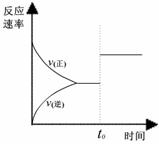
9.在容积不变的密闭容器中存在如下反应: 2SO2(g)+O2(g) 2SO3(g)+Q (Q>0)
2SO3(g)+Q (Q>0)
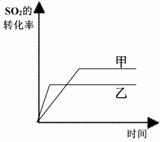 某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
I II III
A.图I研究的是t0时刻增大O2的浓度对反应速率的影响
B.图II研究的是t0时刻加入催化剂后对反应速率的影响
C.图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图III研究的是温度对化学平衡的影响,且乙的温度较低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com