
题目列表(包括答案和解析)
6、根据周期表对角线规则,金属Be与Al单质及其化合物性质相似,又已知AlCl3熔沸点较低,易升华。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式:
。
(2)Be(OH)2与Mg(OH)2可用 试剂鉴别,其离子方程式为:
。
(3)BeCl2是 化合物。(填“离子”或“共价”)
(4)Li与Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是
。
5.某学生课外小组做淀粉水解的实验并制取银镜,首先在试管中加入0.5g淀粉,再加入4mL20%的硫酸溶液,加热使淀粉水解,待淀粉水解完全后,用碱液中和并加入银氨溶液,再把试管放在热水中,静置后形成银镜。请回答下列问题:
(1)怎样证明淀粉已经水解完全? 。
(2)怎样配制银氨溶液?
。
4.下图表示的是用明矾 [KAl(SO4)2·12H2O] 制取硫酸铝和硫酸钾的操作流程图,请根据此图回答有关问题。
|
|
 |
 |
||||||
|
|
||||||

 ①
②
①
②
|
|
|



(1)进行操作②时,加入的试剂是 ,其反应的离子方程式为 ,从反应混合物中分离A所使用的实验装置是 。
(2)进行操作④时,所加入的试剂是 ,其目的是
, 同时要对反应混合物进行的操作是 。
3.某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素质量分数,实验按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后配成250 mL溶液;
③ 准确量取25.00 mL操作②中配得的溶液,置于烧杯中,加入稍适量的溴水,加热使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到蒸发皿内。加热、搅拌,直到固体全部由红褐色变为红棕色后,冷却至室温后,称量;
⑦ ……
请根据上面叙述,回答:
(1) 溶解样品时要加入盐酸,原因是 。
(2)加入溴水后,发生反应的离子方程式是 。
(3) 加入氨水要过量的原因是 。
(4)洗涤的目的是洗去附着在沉淀上的 ,在过滤器上洗涤沉淀的操作是:
。
(5)检验沉淀是否已经洗涤干净的方法是
。
(6)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,且b1-b2=0.3,接下来的操作应当是
。
(7)第⑥步的操作中,使用到的玻璃仪器除玻璃棒外,还有 。
(8)若蒸发皿质量是W1,蒸发皿与加热后固体总质量是W2,则样品中铁元素的质量分数是 。(列出算式,不需化简)
2、(1)化学科学家常用"等电子体"来预测不同物质的结构,例如CH4与NH4+有相同的电子及空间构形。依此原理将下表中空格填出相应的化学式
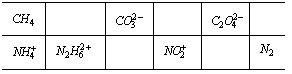
(2)工业上生产尾气中的H2S要经过处理成硫单质后方能排放,以防止大气污染,富玛克斯法治理硫化氢的方法和步骤如下: ①用2%-3%的Na2CO3溶液做吸收剂生成2种酸式盐; ②再加入一种RNO(R表示芳香族有机物的基)与①生成的一种酸式盐的水溶液反应生成硫、碱和R-NHOH; ③第②步生成的碱在溶液中与另一种酸式盐反应生成正盐; ④R-NHOH与空气中的氧发生反应又得到RNO。 (3)写出上述4步反应的化学方程式: ①___________________________ ②___________________________ ③___________________________ ④___________________________
1、为了测定铜与硫按什么原子个数比进行反应, 设计出下列实验:
(1)为确保铜粉中不含氧化铜, 一般要用CO对铜粉进行处理, 首先将铜粉装入硬质玻璃管内, 然后按如下常规操作进行:A. 点燃尾气出口处的酒精灯, B. 通入CO, C. 加热CuO, D. 停止加热, E. 冷却后停止通入CO, F. 熄灭尾气出口处的酒精灯。
若不用上述CO的处理, 请你设计另一简单实验方案, 而达到铜粉中不含氧化铜的目的: ___________________________。
(2)准确称取已处理过的铜粉m克, 与硫粉混合, 然后加热使之反应, 为了保证铜粉充分反应, 应当注意的操作是________________________。
(3)反应产物在称量前还需用________进行处理以除尽其中____________。
(4)称量反应物的质量为n克, 则Cu、S以_________的个数比进行反应。
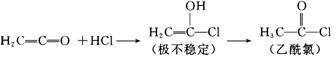
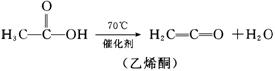
8、已知 乙烯酮与活泼的氢化物易发
生加成反应,如与HCl的反应如下:
从乙酸出发,可发生下图转化:
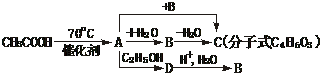
回答下列问题:
(1)上面转化图中,将每一类型反应的个数填入空格,取代反应________个,加成反应_________个,消去反应_________个。
(2)C的结构简式为_______________,D的结构简式为________________。
(3)C的同分异构体甚多,其中含1个-OH和四元环(由3个C、一个O构成)的环酯类化合物有_________种。
(4)写出A D的化学方程式___________________________。
D的化学方程式___________________________。
停课期间
每日一餐(四)
7、近年来科学家发现有100个碳原子构成具有完美对称性的C100原子团,最内层是
由20个碳原子构成的正十二面体(即每个碳原子与其它3个碳原子相连),外层的60
个碳原子形成12个独立的正五边形,处于中间层次的20个碳原子将内、外层碳原子连
接在一起,有关C100的说法正确的是
A、C100跟石墨性质相似,都是原子晶体
B、C100中 碳碳间均以单键相连,不能发生加成反应
C、当与足量氢气完全反应时,生成物分子式为C100H60
D、当与足量氟气完全反应时,生成物分子式为C100F20
6、应用纳米材料给人民币进行杀菌、消毒。我国纳米专家王雪平发明的“WXP复合纳米材料”的主要成分是氨基二氯代戊二醛的含硅衍生物。它能保持长期杀菌作用。有鉴于此,35位人大代表联名提交了一份议案,要求加快将此项新技术应用到人民币制造中去。若戊二醛是直链的,则氨基二氯代戊二醛的同分异构体有
A、4种 B、5种 C、7种 D、8种
5、物质X的结构式如右所示,它常用于回收造纸用水的杀菌剂。其优点是氧化能力强,杀菌效率高,而且无公害。已知X物质水解可产生多种氨、次氯酸、二氧化碳等多种分子。下列关于X物质的说法正确的是
A、X是无机化合物
B、起氧化杀菌作用的水解产物是次氯酸
C、X分子内所有原子均在同一平面内
D、X在过量的NaOH溶液中水解可以产生碳酸氢钠、次氯酸钠等两种盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com