
题目列表(包括答案和解析)
8.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数是23,回答下列问题:
(1)钒被认为是一种稀土元素,广泛存在于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为_____________。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO ,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:
,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:
 VO
VO +H2C2O4
VO++CO2+H2O(未配平)
+H2C2O4
VO++CO2+H2O(未配平)
其中还原剂是__________。若消耗0.9 g草酸,所对应钒元素质量是_____________ g。
停课期间
每日一餐(六)
7. 下图表示各物质之间的转化关系。已知:常温下D、H、I为无色气体,B是一种无色液体。G、F为黑色固体。G和J的式量相等,比I的式量大16。
下图表示各物质之间的转化关系。已知:常温下D、H、I为无色气体,B是一种无色液体。G、F为黑色固体。G和J的式量相等,比I的式量大16。
⑴写出H的电子式:H_________________
⑵写出反应①的化学方程式_______________________________________________
写出反应②的化学方程式_______________________________________________
⑶C在潮湿的空气中会缓慢的生成K,由K分解得到的G、B、H三者的物质的量之比为2∶1∶1,则G的化学式_____________
⑷写出K和E反应的离子方程式_______________________________________________
6.根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。
右图表示298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
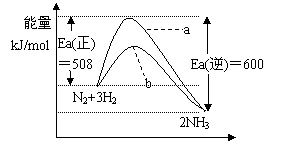 ⑴写出合成氨反应的热化学方程式____________
⑴写出合成氨反应的热化学方程式____________
⑵在图中曲线_____(填a或b)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理________________________________________。
⑶目前合成氨工业广泛采用的反应条件500℃、20-50MPa、铁触媒,反应转化率不超过50%,工业上为了进一步提高氨气产率,你认为下列措施最经济可行的是_________
A.降低反应温度,让反应向着有利于氨气生成的方向进行
B.升高反应温度,让更多的分子变成活化分子
C.寻找能在更低的温度下有很强催化活性的新型催化剂
D.寻找新型耐高压材料,将压强增大一倍
5. 下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
请按要求填空:
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是_____________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是___________________________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
4.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸(HIO3)或高锰酸(HMnO4)溶
液与pH =12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(1)高碘酸是 (填“强酸”或“弱酸”),理由是
。
(2)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的氧化剂是 ,反应的离子方程式可表示为:
。
3.金属钠和铅以物质的量2:5组成的合金可以部分溶于液态氨,得深绿色的溶液A,残留的固体是铅,溶液的成分和残留的成分的质量比为9.44:1。溶液A可以导电,摩尔电导率的测定实验证实,溶液A中除液氨原有的少量离子(NH4+离子和NH2-离子)外,只存在一种阳离子和一种阴离子(不考虑溶剂合离子),而且它们的个数比是4:1,阳离子只带一个电荷。通电电解时,在阳极上析出铅,在阴极上析出钠。用可溶于液氨并在液氨中电离的盐PbI2配制的PbI2液氨溶液来滴定溶液A,达到滴定终点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出。回答下列问题:
(1)溶液A中的电解质的化学式为 。
(2)写出上述滴定反应的离子方程式并配平。
(3)已知用于滴定的碘化铅的浓度为0.009854mol·L-1 ,达到终点时消耗碘化铅溶液20.03mL,问共析出金属铅多少克?
1.电荷相反的离子相互靠近时,由于相反电荷的相互作用,离子的电子云发生变化,称为极化。被异号离子极化而产生离子电子云变形的性质,称为该离子的变形性。阴阳离子都有极化作用和变形性两方面,但由于阳离子的半径小,电场集中,阴离子则相反,所以阳离子的极化作用较大,阴离子的变形性较大。一般说来,阳离子半径越小,电荷越高,极化作用越强;阴离子半径越大,负电荷越多,变形性越强。阴离子被极化后产生变形,正负电荷重心不重合,反过来又可对阳离子产生极化作用,称之为附加极化。附加极化的结果,使阴阳离子产生强烈变形,外层电子云发生重叠,键的极性减弱,键长变短,有离子键向共价键过渡,使物质的溶解度变小,热稳定性降低, 颜色加深…
含复杂阴离子的化合物中,复杂离子中的正态原子对负态原子有极化作用,化合物中的阳离子对阴离子中的负态原子也有极化作用,后一作用与前一作用方向相反,称之为反极化作用。反极化作用的存在表现为阳离子与阴离子中的正态原子共同整体争夺负性原子,使阴离子内部化学键削弱,易发生断键。
(1)BaCO3,FeCO3,ZnCO3,CaCO3分解温度由高到低的顺序是
(2)COF2,COBr2,COCl2,COI2颜色由浅到深的顺序是
(3)试解释Na2CO3的分解温度比NaHCO3高的原因。
(4)碳酸钠易溶于水,碳酸氢钠微溶于水,按理说向饱和的碳酸钠溶液中通入CO2气体应有晶体析出,流行试题就是依此编出来的,当你去做这个实验时,开始时向饱和的碳酸钠溶液中通入CO2气体却没有晶体析出为什么?
8、已知Na2O和Na2O2的混合物109mg和足量水作用,得到300mL溶液,其中含溶质120mg。试计算:
(1)原混合物中Na2O和Na2O2的质量各为多少?常温下所得溶液的pH。
(2)若Na2O和Na2O2的混合物质量为w g ,和足量水作用后得到的溶液中,所含溶质的质量较原混合物增加了a g,试写出a的数值大小范围(以含w的代数式表示)。
停课期间
每日一餐(五)
7、在化工分析中常用到滴定度这个概念。滴定度是指每毫升滴定剂标准溶液相当于被测组分的质量,其单位为g/mL。现有一不溶于水的氧化亚铜样品,该样品能溶于用硫酸酸化了的硫酸铁溶液,所发生的反应可用化学方程式表示为:
Cu2O+Fe2(SO4)3+H2SO4=2CuSO4+2FeSO4+H2O。反应生成的硫酸亚铁可用含硫酸的高锰酸钾溶液进行滴定,其滴定反应可用化学方程式表示为:
2KMnO4+8H2SO4+10FeSO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
若每升滴定剂溶液中含有0.400mol KMnO4 ,求该KMnO4溶液对Cu2O的滴定度。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com