
题目列表(包括答案和解析)
9、 三氯化铁是中学化学实验室中必不可少的重要试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备 FeCl3•6H2O,该同学设计的实验装置如图所示,A中放有m克废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a ,关闭b ,从分液漏斗内向A中加过量的稀盐酸,此时溶液呈浅绿色,再打开b 进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使多余H NO3分解,再降温结晶得FeCl3•6H2O晶体。
填写下列空白:
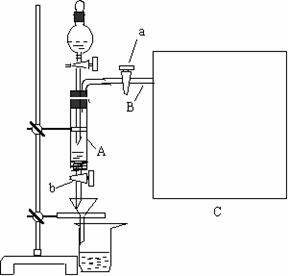 ⑴ 如何检查装置A的气密性:
⑴ 如何检查装置A的气密性:
⑵ 滴加盐酸时,发现反应速率较之同浓度盐酸与铁粉反应要快,其原因是 。
⑶ 将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3•6H2O晶体,而不用直接蒸发结晶的方法来制得晶体的理由
。
⑷ 用该法制得的晶体中往往混有Fe (NO3) 3,为了制得较纯净的FeCl3•6H2O,可将烧杯内的稀硝酸换成 。
⑸ 若要测废铁屑的纯度,可测出从B中放出气体的体积V (已折算成标准状况,单位:L),则废铁屑的纯度为: (用m、V的代数式表示),请在框图C中画出必要的装置。
8、电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。

将浓缩后含CN-离子的污水与过量NaClO溶液的混合液200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
(1) 甲中反应的离子方程式为
乙中反应的离子方程式为
(2) 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。
丙中加入的除杂试剂是 (填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是
(4)戊中盛有足量的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于
请说明该测得值与实际处理的百分率相比偏高还是偏低?简要说明理由______ __
_ _
7、实验室中根据2SO2+O2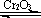 2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。

⑴实验前,必须进行的操作是(填操作名称,不必写具体过程)
⑵在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
⑶小试管C的作用是
⑷广口瓶D内盛的试剂是 。装置D的三个作用是
①
②
③
⑸实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
⑹装置F中U型管内收集到的物质的颜色、状态是
⑺装置G的作用是
⑻从G装置导出的尾气处理方法是
6、 某中学生取纯净的Na2SO3·7H2O 50.00 g,在密闭容器中经600℃以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于同时配制的亚硫酸钠溶液。经过他的实验和思考,这位同学解释了这种反常现象。
(1)他将恒重后的样品溶于水配成溶液,为加速溶解,可采取 的措施,观察发现样品全部溶解,溶液澄清;
(2)取少量(1)中所配溶液,加入足量的 (填一种酸),再加入氯化钡溶液有白色沉淀,说明产物中含有 (填离子符号)。
(3)另取少量(1)中所配溶液于试管中,滴加少量盐酸,看到气泡产生,通过
方法闻到臭鸡蛋气味,说明生成 气体,写出生成该气体的离子反应方程式: ;同时发现溶液变浑浊,原因是:(用离子方程式表示) 。
(4)根据以上实验,该同学经分析解释了以上实验中的反常现象,请你用一个化学方程式表示: 。这一反应在上述实验中 (填是、否或不能确定)完全进行。
5、 图3实验装置中,A、B、C是三支干燥管。B中装有一种干燥剂,C中装着撒在一团玻璃纤维中的浅黄色粉末。广口瓶乙、丙中各有一支点燃的短蜡烛。实验开始打开活塞a、b,关闭c,干燥管A中立即发生反应产生气泡,乙中烛火逐渐熄灭;然后关闭活塞b,打开活塞c,丙中烛火突然变得格外明亮。据此回答以下问题:
图3实验装置中,A、B、C是三支干燥管。B中装有一种干燥剂,C中装着撒在一团玻璃纤维中的浅黄色粉末。广口瓶乙、丙中各有一支点燃的短蜡烛。实验开始打开活塞a、b,关闭c,干燥管A中立即发生反应产生气泡,乙中烛火逐渐熄灭;然后关闭活塞b,打开活塞c,丙中烛火突然变得格外明亮。据此回答以下问题:
 (1)甲装置由烧杯、干燥管、带活塞及单孔橡皮塞的导管构成一个制取气体的简易装置。需要气体时打开活塞a,反应即开始,使气体能连续输出;不需要气体时关闭a,反应即停止。使用很方便。但产气反应要符合一定条件时才适用该装置,条件是___
.(从反应物状态、反应条件及生成气体性质三方面考虑)
(1)甲装置由烧杯、干燥管、带活塞及单孔橡皮塞的导管构成一个制取气体的简易装置。需要气体时打开活塞a,反应即开始,使气体能连续输出;不需要气体时关闭a,反应即停止。使用很方便。但产气反应要符合一定条件时才适用该装置,条件是___
.(从反应物状态、反应条件及生成气体性质三方面考虑)
(2)图4各装置都可用于制取气体,其中与甲装置可达到同样使用效果且原理相同的是(选择图中装置序号) _______________
(3)本实验(图3)中甲装置烧杯中的溶液不可选用___________(选择范围:A稀硫酸,B稀硝酸,C稀盐酸,D碳酸氢钠溶液);甲中反应的离子方程式是_____ ____________________;B中干燥剂不可选用____ ___(选择范围:A碱石灰,B无水氯化钙,C五氧化二磷,D浓硫酸)
(4)干燥管C中发生反应的化学方程式:
4、用右图所示装置进行实验,将A逐滴加入B中:
(1)若A为浓H2SO4,B为第三周期金属元素的片状单质,其在
常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,
则B是 (填化学式),B与浓H2SO4溶液反应的化学方程式为
反应后往烧杯中加人沸水,又可观察到试管C中的现象为
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是 然后往烧杯中加入沸水,
可观察到试管C中的现象是
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,
则A是 (填名称),C是 与葡萄糖的混合液,仪器D在此实验中的作用是
2、取a克样品,配置100mL溶液,取20mL待测液,用C mol/L的标准盐酸滴定至终点,消耗盐酸VmL。试写出样品中氢氧化钠的质量分数的计算式:
_______________ __。
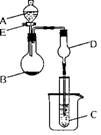
1、若要测定样品中氢氧化钠的质量分数,实验中至少需要测定那些实验数据?_______________________________________。
中和滴定法:
______、溶解、______________________、__________、用标准盐酸滴定至终点。
当滴定至溶液由______色变为_____色,且半分钟不腿色时停止滴定。在相同条件下重复一次。
3、有机合成
有机合成常用的解题方法。
解答有机合成与推断问题的常用方法有“正推法”和“逆推法”。具体的某一个题目是用正推法还是逆推法,还是二者相结合,这要由题目给出的条件决定。近几年考题中出现的问题多以逆推为主,使用该方法的思维途径是:
①首先确定所要合成的有机物属何类别,以及题中所给定的条件与所要合成的有机物之间的关系。
②以题中要求最终产物为起点,考虑这一有机物如何从另一有机物甲经过一步反应而制得。若甲不是所给已知原料,需要进一步考虑甲又是如何从另一有机物乙经一步反应制得,一直推导到题目中给定的原料为终点。
③在合成某一种产物时,可能会产生多种不同的方法和途径,应当在兼顾原料省、产率高的前提下选择最合理、最简单的方法和途径。
☆例题精析
[例1]某小孩偏食,喜欢吃一些豆类物质制成的食品,不喜欢吃动物性食品。该豆类作物中含有的天然蛋白质在酶的作用下,水解生成A、B两种有机物。其中A的化学式是C4H7O4N,B的化学式是C6H14O2N2。已知A、B的分子结构中均不含甲基,且链端都有官能团。
(1)试出A、B的结构简式。
(2)该小孩长期偏食,如不加以纠正,将出现什么后果?
(3)题中的酶的作用是什么?影响其作用的主要因素有哪些?
[例2]已知两个羧基之间在浓硫酸作用下脱去一分子水生成酸酐,如:


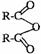 +H2O
+H2O
某酯类化合物A是广泛使用的塑料增塑剂。A在酸性条件下能够生成B、C、D。

(1)CH3COOOH称为过氧乙酸,写出它的一种用途 。
(2)写出B+E→CH3COOOH+H2O的化学方程式 。
(3)写出F可能的结构简式 。
(4)写出A的结构简式 。
(5)1摩尔C分别和足量的金属Na、NaOH反应,消耗Na与NaOH物质的量之比是 。
(6)写出D跟氢溴酸(用溴化钠和浓硫酸的混合物)加热反应的化学方程式:
。
[答案]:
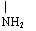
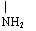 例1(1) A:HOOC-CH2-CH-COOH B、H2N-CH2-CH2-CH2-CH2-CH-COOH
例1(1) A:HOOC-CH2-CH-COOH B、H2N-CH2-CH2-CH2-CH2-CH-COOH
(2)长期偏食, 食物种类过于单一,体内形成的氨基酸种类少导致蛋白质合成受阻,造成营养不良。
(3)该酶作催化剂。影响因素主要有温度和酸碱性。
例2(1)杀菌消毒
(2)CH3-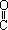 -OH+H2O2→CH3-
-OH+H2O2→CH3-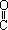 -O-OH+H2O
-O-OH+H2O
(3)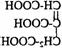
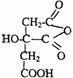
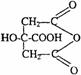
(4)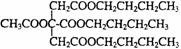
(5)4︰3
(6)CH3CH2CH2CH2OH+HBr CH3CH2CH2CH2Br+H2O
CH3CH2CH2CH2Br+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com