
题目列表(包括答案和解析)
1.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
6、关于中和滴定的误差判断
根据计算关系式:C待= ,判断溶液浓度误差的宗旨是待测溶液的浓度与消耗标准液的体积成正比。任何操作的误差最终均可归结到对所用标准液的体积的影响。
,判断溶液浓度误差的宗旨是待测溶液的浓度与消耗标准液的体积成正比。任何操作的误差最终均可归结到对所用标准液的体积的影响。
※ 例题精析
[例1]下列四种溶液中,由水电离生成的H+ 浓度之比①∶②∶③∶④是( )
① pH=0的盐酸;②0.1mol/l的盐酸
② 0.01mol/L的NaOH 溶液;④pH=14的NaOH 溶液
A、1∶10∶100∶1 B、0∶1∶12∶0 C、14∶13∶12∶14 D、14∶13∶2∶1
[例2]下列各组溶液的c(H+ ) 一定等于1×10-7mol/L的是( )
A、pH=2和pH =12的两种溶液以等体积混合
B、0.05mol/L的硫酸与0.10mol/L的NaOH 溶液以等体积混合
C、将pH=5的CH3COOH 溶液稀释100倍
D、pH=1的H2SO4 与0.10mol/L的Ba(OH)2 溶液以等体积混合
答案:1、A 2、B
5、溶液的稀释规律
(1) 强酸:pH=a,稀释10n倍则pH=a+n(a+n<7);(弱酸:则pH<a+n)
强碱:pH=b,稀释10n倍则pH=b-n(b-n>7);弱碱:则pH>b-n)
(2)酸或碱 无限稀释时(即当c(H+ )或c(OH― ) <10-6mol/L时),应考虑水电离出来的
H+ 或OH― 的影响。切记:“无限稀释7为限”
4、关于溶液pH值的计算
(1) 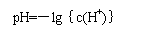 总思路:根据pH的定义:pH=-lg{c(H+)},溶液pH计算的核心是确定溶液中c(H+)的相对大小。具体地,酸性溶液必先确定溶液中c(H+),碱性溶液必先确定c(OH― ),再由c(H+)·c(OH-)= Kw换算成c(H+),然后进行pH的计算。
总思路:根据pH的定义:pH=-lg{c(H+)},溶液pH计算的核心是确定溶液中c(H+)的相对大小。具体地,酸性溶液必先确定溶液中c(H+),碱性溶液必先确定c(OH― ),再由c(H+)·c(OH-)= Kw换算成c(H+),然后进行pH的计算。
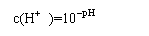

 即:c(H+) pH
即:c(H+) pH
(2)溶液混合后的pH计算
①两强酸混合,先求混合后的c(H+)混,再直接求pH值:c(H+)混=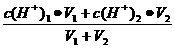
②两强碱混合:先求混合后c(OH― )混,再间接求pH值:
c(OH― )混=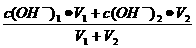
③强酸与强碱溶液混合:根据n(H+)与n(OH―)的相对大小先判断酸、碱的过量情况
a、若酸过量n(H+)>n(OH―),c(H+)混=[n(H+)-n(OH―)]/V总
b、若碱过量n(OH― ) >n(H+ ),c(OH― )混=[n(OH― )-n(H+ )]/V总
c、若酸碱恰好完全反应n(H+)=n(OH―),混合后溶液呈中性。
④未标明酸碱的强弱,混合后溶液pH值不定。应分析讨论。
(3)总结论:酸按酸,碱按碱,同强混合在之间,异强混合看过量。
3、影响水电离的因素
水的电离是电离平衡的一种具体表现形式,所以可以上承下延,从电离平衡的影响因素来思考和理解具体的水的电离平衡的影响因素。
(1) 温度:由于水的电离过程吸热,故升温使水的电离平衡右移,即加热能促进水的电离,c(H+ )、c(OH― )同时增大,Kw增大,pH值变小,但c(H+ )与c(OH― )仍相等,故体系仍显中性。
(2) 酸、碱性:在纯水中加入酸或碱,酸电离出的H+ 或碱电离出OH― 均能使水的电离平衡左移,即酸、碱的加入抑制水的电离。
若此时温度不变,则Kw不变,c(H+ )、c(OH― )此增彼减。
即:加酸,c(H+ )增大,c(OH― )减小,pH变小。
加碱,c(OH― )增大,c(H+ )减小,pH变大。
(3) 能水解的盐:在纯水中加入能水解的盐,由于水解的实质是盐电离出的弱酸根或弱碱阳离子结合水电离出的H+ 或OH― ,所以水解必破坏水的电离平衡,使水的电离平衡右移。即盐类的水解促进水的电离。
(4) 其它因素:向水中加入活泼金属,由于与水电离出的H+ 直接作用,因而同样能促进水的电离。
2、电离平衡与水解平衡的比较
|
|
电离平衡 |
水解平衡 |
|
|
研究对象 |
弱电解质(弱酸、弱强、水) |
盐(强碱弱酸盐、强酸弱碱盐) |
|
|
实质 |
弱酸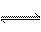 H+ +弱酸根离子 H+ +弱酸根离子弱碱  OH-+弱碱根离子 OH-+弱碱根离子 |
盐电离出的: 弱酸根+H2O  弱酸(根)+OH- 弱酸(根)+OH-弱碱根离子+H2O  弱碱+H+
弱碱+H+ |
|
|
特点 |
①
酸(碱)越弱;电离程度越小 ② 电离过程吸热 ③ 多元弱酸:分步电离且 一级电离>>二级电离>>三级电离 |
①“越弱越水解”(对应酸或碱越弱,水解程度越大) ②水解过程吸热 ③多元弱酸根:分步水解且一级水解>>二级水解>>三级水解 |
|
|
表达方式 |
电离方程式 H2CO3  HCO3― +H+ HCO3― +H+HCO3―  CO32― +H+ CO32― +H+ |
水解方程式 CO32― +H2O  HCO3― +OH― HCO3― +OH―HCO3― +H2O  H2CO3
+OH― H2CO3
+OH― |
|
|
影 响 因 素 |
温度 |
升温,促进电离,离子浓度增大(易挥发的溶质除外) |
升温,促进水解 |
|
浓 度 |
加水稀释 |
促进电离,但离子浓度不增大 |
促进水解 |
|
加入同种离子 |
抑制电离 |
抑制水解 |
|
|
加入反应离子 |
促进电离 |
促进水解 |
1、电解质与非电解质、强电解质与弱电解质的比较:
|
|
电解质 |
非电解质 |
|
|
强电解质 |
弱电解质 |
||
|
电离特点 |
完全电离、不可逆、不存在电离平衡 |
部分电离、可逆、 存在电离平衡 |
本身不能直接电离 |
|
化合物种类 |
强酸、强碱、大多数盐、部分金属氧化物 |
弱酸、弱碱、水 |
多数有机物、 非金属氧化物 |
|
水溶液中溶质 粒子种类 |
水合离子 无溶质分子 |
水合离子和溶质分子 |
溶质分子或与水反应的产物的分子或离子 |
|
结构特点 |
离子键结合的离子化合物、强极性键结合的强极性共价化合物 |
弱极性键结合的弱极性共价化合物 |
极性键结合的弱极性化合物或非极性化合物 |
|
电离方程式 表示方法 |
HCl =H+ +Cl― (用等号) |
CH3COOH CH3COO― +H+ (用可逆符号) CH3COO― +H+ (用可逆符号) |
 |
|
离子方程式中 表示形式 |
可溶:用实际参加反应的离子符号表示 不溶:用化学式表示 |
用化学式表示 |
用化学式表示 |
|
实例 |
HCl、NaOH、NaCl等 |
CH3COOH、NH3、H2O等 |
C2H5OH、SO2、CO等 |
其中:
① 电解质和非电解质的研究对象均为化合物,单质和混合物即不是电解质,也不是非电解质。
② “水溶液或熔化状态”是电解质电离的外部条件,且两个条件具备其中一个即可。如液态HCl不导电,而HCl的水溶液能导电(即其发生了电离),所以HCl是电解质;而作为非电解质则必须是两个条件下均不能电离。
③ “能导电”是因为电解质电离(在水溶液或熔化状态下)产生了自由移动的离子。电解质溶液的导电能力强弱主要取决于溶液中自由移动的离子的浓度大小;离子浓度越大,导电能力越强,与溶液中自由移动的离子数目无关,与电解质的强弱无关。
25、(6’)
 26、(12’)(1)
26、(12’)(1)
|
编
号 |
① |
② |
③ |
④ |
|
组成A的物质 的化学式 |
|
|
|
|
(2)
24、(1) 甲_________________________________。
乙_________________________________。
(2)①__________ ②__________________________________________
③____________
23、(14’)(1)A ________,B ___________。(2)__________(填序号)
(3)___________(4)__________
(5)(Ⅰ)____________
(Ⅱ)________, __________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com