
题目列表(包括答案和解析)
21. (15分)现有某黄铜(铜、锌合金)的颗粒状样品约100mg,李洋同学将样品分为两等份,首先用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原于质量。回答下列问题:
(15分)现有某黄铜(铜、锌合金)的颗粒状样品约100mg,李洋同学将样品分为两等份,首先用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原于质量。回答下列问题:
(1)加入稀硫酸和黄铜中的锌完全反应,应如何操作?
_________________________________________________________________________;反应前、后碱式滴定管中的液面高度与干燥管中的液面高度均应保持相同,反应充分进行后,如何使碱式滴定管中的液面高度与干燥管中的液面高度相同?
___________________________________________ 。
(2)为了保证实验结果的准确,请你将本实验过程中需直接测定的有关物理量填人下表中
(用文字说明,不必填满):
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
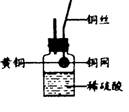 (3)李洋同学还想改用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原子质量。
(3)李洋同学还想改用右图所示装置测定黄铜样品中锌的质量分数和锌的相对原子质量。
①该实验过程中,必须对反应后所剩的固体进行洗涤、干燥,如何确保所得固体是干燥的?
__________________________________________________
②陆老师组织班级同学从该实验装置、中学化学实验室的现有条件两方面,对该实验方案的可行性进行评价,请你参与讨论,并发表你的看法。
___________________________________________________________________________________________________________________________________________ 。
20.(5分)(1)用焰色反应检验NaOH溶液中的钠元素时,在用铂丝蘸取NaOH溶液之前必须进行的操作是________________________________ 。
确保该实验能成功进行的关键因素是____________________、__________________________、_____________________________。
19.某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA-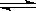 H++A2-。有体积各为10mL的下列四种溶液:①0.02mol/L H2A溶液;②0.02mol/L NaHA溶液;③浓度均为0.02mol/L的Na2A和NaHA的混合溶液;④0.02mol/LNa2A溶液,则下列说法中正确的是
H++A2-。有体积各为10mL的下列四种溶液:①0.02mol/L H2A溶液;②0.02mol/L NaHA溶液;③浓度均为0.02mol/L的Na2A和NaHA的混合溶液;④0.02mol/LNa2A溶液,则下列说法中正确的是
A.四种溶液中c(H+)的关系:①>②>③>④
B.四种溶液中离子总数的关系:④>③>②>①
C.在②的溶液中一定有:c<(Na+)>c (HA-)>c (OH-)>c (H+)
D.在①的溶液中:c (H+)=c(HA-)+c (A2-)+c (OH-)
18.将2 mol A和1 mol B充人某密闭容器中发生反应:2A (g)十B (g) 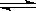 xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
xC(g),达到化学平衡后,C的体积分数为a。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
A.若在恒温恒压下,当x=1时,按1.5 mol A、1 mol C作为起始物质,达到平衡后,C的体积分数仍为a
B、若在恒温恒容下,当x=2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为a
C.若在恒温恒压下,当x=3时,1 mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为a
D.若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为a,则x为2或3
17.下列实验操作中,错误的是
A.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2-3次
B.制取乙酸乙酯时,导管不能插入饱和Na2CO3溶液液面以下
C.用盐酸和NaOH溶液测定中和热时,可以使NaOH稍过量
D.配制1.0 mol/L硫酸溶液时,将量取的浓硫酸放入容量瓶中加水稀释
16.下列有关物质的结构或性质的叙述错误的是
A.水是一种非常稳定的化合物,这是由于氢键所致
B.由极性键形成的分子不一定是极性分子
C.H2O、HF、NH3、CH4的沸点依次降低
D.分子晶体中一定存在分子间作用力,可能有共价键
15.下列方案合理的是
A.用饱和碳酸钠溶液来除去乙酸乙酯中混有乙酸、乙醇杂质;
B.用NaOH溶液除去溴乙烷中混有的Br2;
C.用通入O2来除去二氧化氮中少量的一氧化氮;
D.用滴加BaCl2溶液的方法除去Na2SO3溶液中的Na2SO4
14.下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钠溶液与明矾溶液混合:
Ba2++3OH-+Al3++ SO42-=BaSO4↓+Al(OH)3↓
B.向苯酚钠溶液中通人少量CO2:C6H5O-+CO2+H2O→C6H5OH↓+HCO3-
C.向硫代硫酸钠溶液中滴人过量稀硫酸:4H++2S2O32-=3S↓+ SO42-+2 H2O
|
13.巳知25℃、l0lkPa下,石墨、金刚石燃烧的热化学方程式分别为;
C(石墨)+O2(g)=CO2(g);△H=-393.51kJ/mol
C(金刚石)+O2(g)=CO2(g);△H=-395.4l kJ/mol 据此推理所得到的下列结论正确的是
A.金刚石的燃烧热比石墨的燃烧热小 B.石墨晶体中碳碳键的强度小于金刚石
C.石墨的能量比金刚石的能量高 D.由石墨制备金刚石-定是吸热反应
12.下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀。试组离子可能是
A.Na+、Cu2+、NO3-、CO32- B.Ba2+、K+、Cl-、HCO3-
C.Fe2+、Na+、SO42-、NO3- D.Mg2+、NH4+、SO42-、Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com