
题目列表(包括答案和解析)
24.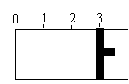
 (10分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应:2 SO2 (g) + O2 (g) 2 SO3
(g) 。
(10分)一定温度下,向如图所示的带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应:2 SO2 (g) + O2 (g) 2 SO3
(g) 。
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,容器内,V(SO3)=_____________L;该反应中SO2 的转化率为________。
(2)若开始时,充入容器的起始物质分别是①2 L SO2 和1 L O2 ;②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g),使活塞固定在“3”处,达到平衡后,容器中SO3 (g)的体积分数大小关系是 (用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量,写出SO2 发生氧化反应的热化学方程式:_____________________________________________________________。
23.(8分)有资料报道:铁酸钠(Na2FeO4)是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+离子,使用该物质可代替Cl2和Al2(SO4)3。
(1)用废铁屑制Fe2O3 。向有铁锈的废铁屑中加入稀硫酸,至铁屑全部溶解。再通过系列化学过程得到Fe2O3 。写出向有铁锈的废铁屑中加入稀硫酸过程中的离子反应方程式。
________________________________________________________________________。
(2)制备铁酸钠。氧化铁在碱性溶液中与硝酸钠反应制得铁酸钠。
Fe2O3 +NaNO3 +NaOH → Na2FeO4+NaNO2 +H2O (未配平)
当反应物中含有1.4 mol Na+ ,上述反应恰好完全进行时,电子转移总数为_______NA。
(3) 制备铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,下列试剂中①NaCl ②NH4Cl ③KMnO4 ④浓硫酸,能使NaNO2转化为N2(不引起二次污染的)的是______(选填试剂编号),离子反应方程式____________________________________。
22.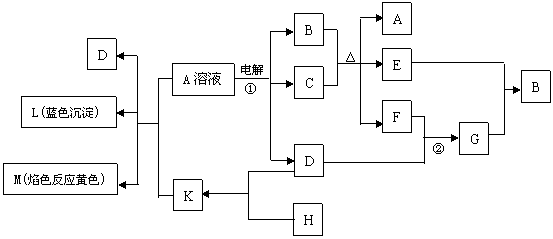 (10分) 下列物质的相互转化关系中,已知B是基础化学工业的重要产品,它的消费量常被视为一个国家工业水平的一种标志,K是含非极性键的离子化合物,E是无色无味的液体。试回答:
(10分) 下列物质的相互转化关系中,已知B是基础化学工业的重要产品,它的消费量常被视为一个国家工业水平的一种标志,K是含非极性键的离子化合物,E是无色无味的液体。试回答:
(1)G的化学式为___________________,K的电子式为_____________________。
(2) 反应①的离子方程式____________________________________________。
(3) 反应②工业上称F为接触氧化反应,根据化学平衡理论和下表F转化率的实验数据,考虑综合经济效益,你认为提高F转化率工业上应采取的反应条件及有效措施是
_______________________________________________________ 。
|
|
0.1 MPa |
0.5 MPa |
1 MPa |
10 MPa |
|
400 ℃ |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 ℃ |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 ℃ |
73.7 |
85.8 |
89.5 |
96.4 |
21.(12分)下表是元素周期表中的一部分。根据表中所列部分元素,回答有关问题。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
|
|
|
⑨ |
|
⑩ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) 载人航天器的宇航员活动仓内需要营造一种适合宇航员生存的人工生态环境,应该在元素⑥的一种常见的单质中充入一种气体且达到规定的比例,该气体分子的电子式是_______________。铁是航天器中用量较大的金属,请将铁元素符号填入上述周期表中。
(2) 已知某些不同族元素的性质有一定的相似性(所谓周期表对角线规则),写出与元素⑨对角的主族金属元素的氢氧化物与NaOH溶液反应的化学方程式________ __________________________。
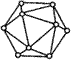 (3) 元素③的单质晶体熔点为2573K,沸点2823K,硬度大,则该晶体属于_________晶体。已知该晶体的基本结构单元是由该元素原子组成的正二十面体(如图所示),其中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个原子。通过观察图形及推算得出此基本结构单元中含有共价键数为__________。
(3) 元素③的单质晶体熔点为2573K,沸点2823K,硬度大,则该晶体属于_________晶体。已知该晶体的基本结构单元是由该元素原子组成的正二十面体(如图所示),其中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个原子。通过观察图形及推算得出此基本结构单元中含有共价键数为__________。
(4) A、B、C、D是上述①-⑩中的四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙分子含有相同数目的质子,则A元素是_________(填序号)。除A分别与B、C、D结合生成甲、乙、丙化合物外,C和D也可结合生成化合物丁。B、C、D三种元素的单质和甲、乙、丙、丁四种化合物可以相互转化:B(单质)+乙→ C(单质)+甲;C(单质)+丙→ 乙+丁。则B的原子结构简图为____________,丙的化学式为______________。
20.
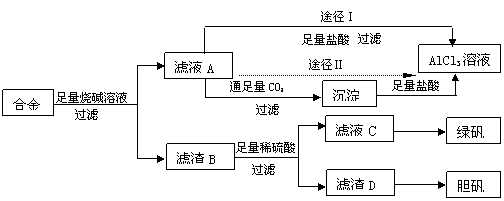 (10分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),拟用如下实验方案:
(10分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),拟用如下实验方案:
试回答下列问题:
(1)实验中多次进行过滤操作,过滤所用的玻璃仪器有 。
(2)从滤液C中得到绿矾晶体的实验操作是 ___________。
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 __________________ 。
(4)由滤液A得AlCl3溶液的途径有Ⅰ和Ⅱ,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
19.(8分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。某同学用下列简单方法测定阿佛加德罗常数,具体步骤为:
①将NaCl固体细粒干燥后,用托盘天平称取m g NaCl固体细粒并转移到100 mL容量瓶中。
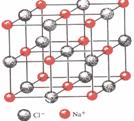 ②用仪器A向容量瓶中加苯,不断振荡,继续加苯到容量瓶的刻度,计算出NaCl固体的体积V cm3。
②用仪器A向容量瓶中加苯,不断振荡,继续加苯到容量瓶的刻度,计算出NaCl固体的体积V cm3。
(1)步骤②中仪器A应使用 (填序号)。
A.量筒 B.滴管
C.碱式滴定管 D.酸式滴定管
(2) 能否用水代替苯 ,理由是
。
(3) 已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如上图),则用上述方法测得的阿佛加德罗常数NA的表达式为 。
(4) 实验中测得的阿佛加德罗常数与理论值有一定的误差,你认为影响该实验精度的主要原因是__________________________________________________________________。
18.将16 g FeS与FeO的混合物,投入到含有1 mol的硝酸溶液中充分反应,只产生1/3 mol NO气体,得到澄清的混合溶液,下列计算结果正确的是
A.混合物中含有8 g FeO
B.混合物中含有0.1 mol FeS
C.被还原的HNO3 为1/3 mol
D.参加反应的HNO3 为1 mol
第二卷(非选择题 共76分)
17.T °C时气体A与气体B反应生成气体C和固体D。每1 mol A与足量B完全反应时生成1 mol D。反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图②所示。则下列结论正确的是

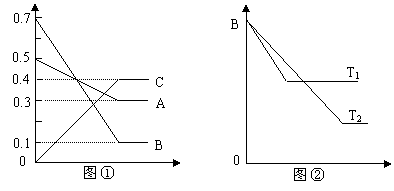
 A.该反应的化学方程式是 A+3B 2C+D
A.该反应的化学方程式是 A+3B 2C+D
B. T°C若向上述平衡体系中加入0.2 mol C,平衡时A的浓度大于0.3 mol/L
C.升高温度,其它条件不变时,,正、逆反应速率均增大,且A的转化率增大
D.相同时间内,消耗0.1 mol/L A时,生成了0.3 mol/L B,反应达到平衡
16.将一小块焦炭和x g O2同时放入装有压力表的密闭容器中,压强为P0。当在一定条件下充分反应后恢复到原温度,压强为P1,且P0<P1<2P0,则加入焦炭的质量m为
A.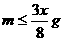 B.
B.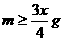
C.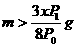 D.
D.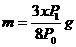
15.假设SiO2 原子晶体中Si原子被Al原子取代,不足的价数由K原子补充。当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为
A.KAlSiO4 B.KAlSi2O6
C.KAlSi3O8 D.KAlSi4O10
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com