
题目列表(包括答案和解析)
4.已知在101kPa、273K时,15g乙烷燃烧生成CO 2 和液态水,放出a kJ热量,下列热化学方程式正确的是 ( )
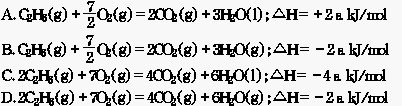
3.在c(H + )=1×10 -13 mol·L -1 的溶液中,能够大量共存的一组离子是 ( )
A.Fe 2+ NO3 - Na + Cl - B.Ba 2+ Na + NO 3- Cl -
C.Al 3+ NH +4 Cl - SO 42- D.Mg 2+ NO3 - AlO 2- Br -
2.下列各组物质,无论它们以何种物质的量之比发生反应,都可用同一离子方程式表示的是( )
A.偏铝酸钠和盐酸 B.澄清石灰水和二氧化碳
C.溴化亚铁和氯气 D.碳酸氢钠和盐酸
1.某种原子可以表示为 AZ X,对该原子的下列说法中,正确的是 ( )
A.A一定大于Z B.A一定小于Z
C.A一定等于Z D.A可能等于Z
第Ⅱ卷 (非选择题,共90分)
28.
(1) H+ + OH- = H2O NH4+ +
OH- NH3↑+ H2O
(各1分共2分)
NH3↑+ H2O
(各1分共2分)
(2)由于实验序号(Ⅰ)和(Ⅱ)的样品质量与产生氨气的体积成正比,说明40mLNaOH溶液是过量的。故3.7g样品进行同样实验时,NaOH溶液也是过量的。 (1分)
所以,在标准状况下生成氨气的体积为: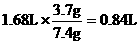 。 (1分)
。 (1分)
(3)在实验序号(Ⅰ)和(Ⅱ)的样品质量与产生氨气的体积成正比,说明NaOH溶液是过量的,样品完全反应。现选取实验序号(Ⅱ)来计算,设14.8g的样品中,n[(NH4)2SO4] = x
n(NH4HSO4) = y,与过量NaOH溶液反应后,生成在标准状况下的氨气的体积为3.36L,
即0.15mol。则 (1分)
 (1分)
(1分)
得 (1分)
(1分)
即14.8g的样品中,(NH4)2SO4和NH4HSO4的物质的量之比为0.025 mol:0.10 mol =1:4。
(用实验序号(I)数据计算也可以)
(4) 选择第Ⅲ组数据 (1分)
在本实验中,OH-先与H+反应,后与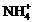 反应,而在实验序号(Ⅲ)和(Ⅳ)中样品的质量增加,与NaOH溶液反应生成的氨气的体积无增加,说明NaOH溶液是不足的,而且实验序号(Ⅳ)中无氨气生成,不能计算NaOH与
反应,而在实验序号(Ⅲ)和(Ⅳ)中样品的质量增加,与NaOH溶液反应生成的氨气的体积无增加,说明NaOH溶液是不足的,而且实验序号(Ⅳ)中无氨气生成,不能计算NaOH与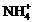 反应的量,同时也无法计算OH-与H+反应的量。故选择第Ⅲ组数据来计算。
反应的量,同时也无法计算OH-与H+反应的量。故选择第Ⅲ组数据来计算。
从(3)计算结果可知:在实验序号(Ⅲ)中,22.2g的样品中,
有0.025mol×1.5 = 0.0375mol(NH4)2SO4和0.1mol×1.5 = 0.15mol NH4HSO4 (1分)
 (1分)
(1分)
所以,NaOH溶液的物质的量浓度为: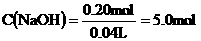 /L
(1分)
/L
(1分)
27.(8分)解:Ba(OH)2 + CO2 = BaCO3↓+ H2O Ba(OH)2 + 2HCl = BaCl2 + 2H2O
|
|
原Ba(OH)2 的浓度为 ---------------×- = 0.0910 mol·L-1 (2分)
|
|
吸收CO2后Ba(OH)2 的浓度为---------------×- = 0.0510 mol·L-1
n(CO2)= (0.0910 mol·L-1 - 0.0510 mol·L-1)×50.0 mL×10-3 L·mL-1 = 2.00×10-3 mol
|
CO2的体积分数为------------×100% = 4.48 % (2分)
26.(12分)[答案](1)ABCD (1分)
(2)2AgBr  2Ag+Br2。(1分) 2Ag+Br2
2Ag+Br2。(1分) 2Ag+Br2 2AgBr,(1分) 催化作用 (1分)
2AgBr,(1分) 催化作用 (1分)
(3)①CH2=CHCH3 (1分) (CH3)2C(OH)COOH (1分)
②氧化 (1分) 消去 (1分)
③CH2ClCH2Cl+2H2O
 HOCH2CH2OH+2HCl (2分)
HOCH2CH2OH+2HCl (2分)
HOCH2CH2OH+CH2=C(CH3)COOH
 CH2=C(CH3)COOCH2CH2OH+H2O
(2分)
CH2=C(CH3)COOCH2CH2OH+H2O
(2分)
24.(11分,每空1分)
(1)
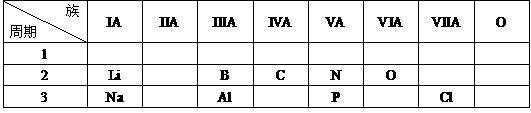
(2)X值越大,原子半径越小
(3)氢氟酸

 25.答案:(1)31(2分)
25.答案:(1)31(2分)
(2)
23.⑴H2O N2 Ag
HCl ⑵4NH3+5O2
 4NO+6H2O ⑶AgN3
4NO+6H2O ⑶AgN3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com