
题目列表(包括答案和解析)
2、下列有关晶体的说法中,错误的是( )
A、碳、硅为同主族元素,故CO2与SiO2结构相似,晶体类型相同
B、在NaCl晶体中,每个钠离子周围紧邻6个氯离子
C、由C60构成的晶体属于分子晶体,熔、沸点较低
D、在金刚石的晶体结构中,由共价键形成的最小碳环为六元环
1、可持续发展是我国的既定方针。但随着现代工业不断发展,环境污染愈来愈影响人类社会的可持续发展。下列有关环境污染及防治的说法正确的是( )
A、日常使用的含磷洗涤剂会对水体造成污染,使水的物理、化学性质发生变化
B、《关于消耗臭氧层物质的蒙特利尔议定书》等国际公约的主要内容是要求各国减少并逐步停止氮氧化物等的生产和使用,以保护臭氧层
C、不使用矿石燃料是减少大气污染的唯一方法
D、我国目前计入空气污染指数(Air Pollution Index,简称API)的项目暂定为:二氧化硫、二氧化氮和可吸入颗粒物等
3、酸式盐在溶液中的酸碱行为:电离与水解。
※例题精析
[例1]已知 Na2HPO4溶液呈碱性,Na2HPO4溶液中又存在平衡:HPO42― +H2O

H3O+ +PO43―。若使Na2HPO4稀溶液中HPO42― 、H3O+、PO43―三种离子的浓度都降低,应向溶液中加入( )
A、H2O B、NaOH C、Ca(OH)2 D、BaCl2
[例2]把0.02mol/L CH3COOH溶液和0.01mol/L NaOH以等体积混合(溶液显酸性),混合溶液中粒子浓度关系正确的是 ( )
A、 c(CH3COO―)>c(Na+) B、c(CH3COOH)>c(CH3COO―)
C、2c(H+)=c(CH3COO―)―c(CH3COOH) D、c(CH3COO―)+c(CH3COO―)=0.02mol/L
[例3]能正确表示下列化学反应的离子方程式是( )
A、用碳酸钠溶液吸收少量SO2 :2CO32―+SO2+H2O=2HCO3― +SO32―
B、金属铝溶于盐酸中:Al +2H+ =Al3+ + H2↑
C、Na2SO3 溶于水中:SO32― +H2O ==SO2↑+2OH―
D、碳酸镁溶于水HNO3中:CO32― +2H+ = H2O + CO2↑
[例4]在加入铝粉能产生H2的溶液中,下列各组离子,可能大量共存的是( )
A、NH4+ NO3― CO32― Na+ B、Na+ Ba2+ Mg2+ HCO3―
C、NO3― Mg2+ K+ Cl― D、NO3― K+ AlO2― OH―
[例5]工业上制备纯净的氯化锌时,将含杂质的氧化锌溶于过量的盐酸,为了除去杂质需要调节溶液的pH值到4,应加入试剂是( )
A、氢氧化钠 B、氨水 C、氧化锌 D、氯化锌
[例6]下列盛放试剂的方法正确的是 ( )
A、氢氟酸或浓硝酸存放在带橡皮塞的棕色玻璃中
B、汽油或煤油存放在带橡皮塞的棕色玻璃中
C、碳酸钠溶液或氢氧化钙溶液存放在配有磨口塞的棕色玻璃瓶中
D、氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中
[例7]已知CH3COOH的酸性比H2CO3强,则CH3COONa溶液的 性(填酸、碱)比Na2CO3溶液 (填强、弱)。
[例8]如何证明Fe(OH)3是弱碱?如何操作?
2、六类物质的水解:
盐类的水解、卤代烃的水解、金属碳化物的水解、酯的水解、糖类的水解、蛋白质的水解。
1、水解规律:
(1)有弱就水解,无弱不水解,越弱越水解,谁强显谁性;盐类水解属复分解反应,有机水解属取代。
(2)四类盐的水解:强酸弱碱盐、弱酸强碱盐、弱酸弱碱盐、酸式盐。
2、 必须符合反应事实
(1)化学用语是否准确,化学式、离子符号、沉淀、气体符号、等号、可逆符号的书写是否符合反应事实。一般易溶于水的强电解质在水溶液中应写成离子符号;不溶于水的电解质,可溶于水的弱电解质及所有的非电解质、单质和氧化物均应写成化学式。如:CaCO3 、CH3COOH、SO2、Na2O2、Fe、C2H5OH、H2SiO3等均应在离子方程式中写成化学式。至于强电解质的微溶物在生成物中一般写成化学式,反应物中则看情况而定,如:石灰乳则写成Ca(OH)2,而澄清的石灰水则应拆写成Ca2+和2OH―
,又如:NH4+和OH―
反应,一般未说明或在浓溶液中或加热应写成NH4++OH― = NH3↑+H2O,而在稀溶液中反应可写成NH4++OH― =NH3·H2O。弱电解质的电离、弱电解质离子的不完全水解及常见的可逆反应均用可逆符号。如:Cl2+H2O HCl+HClO、NH4++CH3COO―+H2O
HCl+HClO、NH4++CH3COO―+H2O CH3COOH+NH3·H2O。
CH3COOH+NH3·H2O。
(2)氧化还原反应是否符合反应事实:主要是看反应能否进行或反应产物是否正确。Fe 和H+反应只能生成Fe2+和H2,而非Fe3+和H2 。
(3)与量有关的反应是否表达准确。由于许多反应是分步进行的,则离子方程式的书写应根据反应物的量的关系来确定反应进行的程度。如未给出反应物的量的关系,则不同程度反应的离子方程式均认为可能发生。如FeBr2和Cl2反应,Cl2不足,则应写成2Fe2++Cl2 =
2Fe3+ +2Cl― ;若Cl2 过量,则应写成2Fe2++4Br― +3Cl2 =2Fe3+ +2Br2 +6Cl― 。若未加说明反应的量的关系,则二者均可。
1、 必须遵守“三大守恒”
离子方程式都要遵守三大守恒规律:
①方程式两边元素的种类守恒;
②方程式两边原子个数应守恒;
③方程式两边各离子所带电荷数的代数和应守恒。
12.

11.
 (4分结果正确单位错扣1分)
(4分结果正确单位错扣1分)
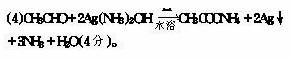
10.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com