
题目列表(包括答案和解析)
2.同位数
(1)同位数的概念:具有相同质子数不同中子数的一类原子互称同位素。
(2)性质:物理性质不同,化学性质基本相同。
(3)应用
1.原子内的各种关系
(1)原子序数=质子数=核电荷数=核外电子数
(2)质量数(A)=质子数(Z)+中子数(N)
(3)质子数(Z)=离子的核外电子数+离子的电荷数(阳离子电荷数为正值,阴离子为负值)
26、(10分)将30.0 g铁粉(过量)与44.0 mL浓硫酸在加热条件下充分反应,共收集到11.2 L(标准状况)气体,其质量为19.6 g。试计算:
(1) 浓硫酸的物质的量浓度;
(2) 反应后剩余铁粉的质量。
25、(8分)向100 mL蒸馏水中加入钠和铝的混合物15 g,充分反应后发现剩余金属5.0 g,求放出的氢气在标准状况下的体积为多少升?
24、(12分)某无色溶液中可能含有Na+、SO42-、SO32-、CO32-、Cl-、Br-这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:
①用PH试纸试验,溶液的PH > 7;
②向溶液中滴加过量氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙色,用分液漏斗分液;
③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,只有白色沉淀产生,过滤;
④在滤液中加AgNO3和HNO3的混合溶液,有白色沉淀产生。
回答下列问题:
(1)原溶液中肯定存在的离子是
(2)分液漏斗中的上层液体如何转移到烧杯中
(3)若步骤③使用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响?
(4)写出步骤②中发生反应离子方程式 。
23、(8分)实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg = Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1 mol CuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-= CuI+ I3-
22、(9分)化工行业已合成有一种硬度比金刚石还大的晶体--氮化碳,若已知氮在化合物中显-3价,推断:
(1)其化学式可能是
(2)其晶体类型是
(3)你认为其硬度比金刚石大的主要原因是
21、(6分)1836年,俄国化学家盖斯提出了化学反应的热效应仅与化学物的最初状态和生成物的最终状态有关,而与其中间步骤无关。按此规律,结合下述反应方程式,回答问题。
已知火箭发射时可用肼(N2H4)作燃料和NO2作氧化剂,这两者反应生成氮气和水蒸气。
(1)N2(g) + 2O2(g) = 2NO2(g);△H = + 67.8kJ/mol
(2)N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = -534kJ/mol
计算1mol气体肼和NO2完全反应时放出热量为 kJ。
写出肼与NO2反应的热化学方程式
20、(16分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含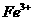 的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是
。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
19、(9分)分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化。(供选用的药品和仪器:明矾溶液、甲基橙试液、石蕊试液、酚酞试液、PH试纸、氢氧化钠溶液、酒精灯、半透膜、电泳仪、聚光束仪)
(1)证明明矾发生了水解反应 。
(2)证明明矾的水解反应是一个吸热反应: 。
(3)证明明矾溶于水时生成了胶体溶液: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com