
题目列表(包括答案和解析)
2.条件不同产物不同的例子
(1)温度不同,产物不同
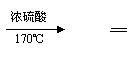
CH3CH2OH CH2 CH2 + H2O

2CH3CH2OH C2H5OC2H5 + H2O
(2)溶剂不同,产物不同

CH3CH2Br +H2O C2H5OH + HBr

CH3CH2Br + NaOH CH2 CH2 + NaBr +H2O
(3)浓度不同,产物不同
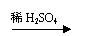
(C6H10O5)n +n H2O nC6H12O6

(C6H10O5)n 6nC +5nH2O
 (4)条件不同,产物不同
(4)条件不同,产物不同


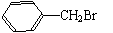
+ Br2 + HBr



+ Br2 + HBr

例题精析:
例1:有机化学中取代反应范畴很广。下列五个反应中,属于取代反应的是________。

A.CH3COONa + NaOH Na2CO3 + CH4 ↑
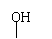

 B.CH3CH2CHCH3
CH3CH2CH CHCH3 + H2O
B.CH3CH2CHCH3
CH3CH2CH CHCH3 + H2O

C.2 CH3CH2OH CH3CH2OCH2CH3 + H2O
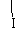

 D.(CH3)2CHCH CH2 + HI
(CH3)2CHCHCH3
D.(CH3)2CHCH CH2 + HI
(CH3)2CHCHCH3

E.CH3COOH + CH3OH CH3COOCH3 + H2O
例2:由2-氯丙烷(CH3CHClCH3)制取1,2-丙二醇(CH3CHOHCH2OH)时,依次发生的反应是: ( )
A.加成→消去→取代 B.消去→加成→取代
 C.取代→消去→加成
D.取代→加成→消去
C.取代→消去→加成
D.取代→加成→消去
例3:某有机物的结构简式为
,
它在一定条件下可能发生的反应有:
①加成 ②水解 ③酯化④氧化 ⑤中和 ⑥消去 ( )
A.②③④ B.①③⑤⑥ C.①③④⑤ D.②③④⑤⑥
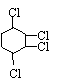

例4.






















 现通过以下步骤由 制取
现通过以下步骤由 制取







|



|


 ① ② ③
④
⑤
⑥
① ② ③
④
⑤
⑥
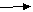

 (已知C C C不稳定)
(已知C C C不稳定)
(1)从左到右依次每步反应所属的反应类型(a为取代,b为加成,c为消去,d为加聚,只填字母)。
① ② ③
④ ⑤ ⑥
(2)写出①、③两反应所需的试剂和条件:
 ① ③
① ③
(3)写出 的化学方程式
答案:例1,A、C、E、F; 例2,B; 例3,C;
例4,(1)①a ②b ③c ④b ⑤c ⑥b
(2)Cl2和Fe(或FeCl3);NaOH醇溶液,加热;
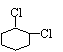 (3)
(3)


+ 2NaOH + NaCl + 2H2O


 + 2Cl2
+ 2Cl2
1.有机反应的条件与反应类型:
|
反应条件 |
反应类型 |
|
催化剂、加热、加压 |
乙烯水化;乙烯被空气氧化;油脂氢化 |
|
催化剂、加热 |
乙烯、乙炔加氢、乙炔加HCl;醇去氢氧化缩聚反应 |
|
水浴加热 |
苯的硝化反应、银镜反应、制酚醛树脂、酯类、糖类水解 |
|
只需加热 |
制甲烷、醇的卤代、醛基氧化、卤代烃的水解与消去(需注明试剂) |
|
浓硫酸、加热 |
乙醇脱水与消去(须注明温度)、硝化、酯化反应 |
|
稀硫酸、加热 |
酯、二糖、多糖和蛋白质水解 |
|
稀NaOH溶液、加热 |
酯的水解、油脂的皂化 |
|
只需催化剂 |
苯的溴代、乙醛被空气氧化、加聚反应、葡萄糖制乙醇 |
|
不需外加条件 |
烯、炔加溴、烯、炔、苯的同系物被KMnO4、苯酚的溴代 |
5.金属活动性顺序表的应用
(1)判断金属与酸反应的产物
a 氢以前的金属能置换出非氧化性酸中的氢
2Al+3H2SO4=Al2(SO4)3 +3H2
b 氢以后的金属不能跟非氧化性酸反应,只能跟强氧化性酸反应
3Cu +8HNO3 (稀)=3 Cu(NO3)2 + 2NO +4 H2O
c 氢以前的金属与氧化性酸反应的产物与金属活泼性、酸的浓度、温度等多种因素有关。
d Fe、Al在冷的浓H2SO4 、浓HNO3 中钝化
(2)判断金属与盐溶液反应的产物
a 除活泼金属(K、Ca、Na、Mg、Ba等)外,前面的金属能将后面的金属从其盐溶液中置换出来:Fe+CuSO4 =FeSO4+Cu
b 后面的金属也可与前面的金属离子发生氧化还原反应:2Fe3++Cu =2Fe2++Cu2+
c 其它情况:3Zn +2FeCl3 + 6H2O =2Fe(OH)3 ↓+3ZnCl2 +3H2 ↑
(3)判断金属与水反应的产物
a K、Ca Na 遇冷水迅速反应放出H2
b Mg 在冷水中反应缓慢,在沸水中反应快
c Al 在冷水中不反应,在沸水中反应微弱
d Zn、Fe、Sn、Pb能在红热的条件下与水蒸气反应,产生H2 。
3Fe+4H2O (g)= Fe3O4 + 4H2
e 氢以后的金属不与H2O 反应
(4)判断原电池的电极和电极反应式:活泼的金属作负极,失去电子,发生氧化反应。
(5)判断电解时阴极阳离子放电顺序:
Ag+ >Fe3+ >Hg2+>Cu2+ >H+ >Pb2+>Sn2+>Fe2+ >Zn2+>(H+ )>Al3+ >Mg2+ >Na+ >Ca2+ >K+
(6)判断金属原子还原性和金属离子氧化性的大小
a 金属原子的还原性:K→Ag 逐渐减弱
b 金属离子的氧化性:K+→Ag+ 逐渐增强
(7)判断金属冶炼的方法
a K→Al 熔融电解
b Zn →Cu 用还原剂C、CO、H2 或熔融电解
c Hg →Ag 加热其氧化物
d Pt 、Au 物理方法
(8)判断不溶性碱热稳定性的大小
规律:金属越活泼,其氢氧化物越不易分解
a KOH、NaOH、Ca(OH)2,1000℃以上
b Mg 至Cu 酒精灯加热
c Ag、Hg常温下分解
d Pt、Au无氢氧化物
(9)判断可溶性碱的碱性强弱
规律:金属越活泼,其氢氧化物的碱性越强
(10)判断单质能否与O2反应及其产物
a K到Na 常温下易氧化
b Mg 到Fe常温下可氧化,加热易氧化
c Sn 到Ag 高温下氧化
d Pt、Au不氧化
(11)判断金属元素在自然界中的存在状态
a K到Pb化合态
b Cu、Hg、Ag化合态和游离态
c度Pt、Au游离态
(12)判断金属氧化物的水化情况
a K到Mg 能与水反应
b Al到Au 不作用
例题精析
[例1]已知 2Fe2+ +Br2 = 2Fe3+ +2Br― ,若向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,测得形成的溶液中Cl― 和Br― 的物质的量浓度相等,则原FeBr2 溶液的物质的量浓度为 ( )
A.0.75mol/L B.1.5mol/L C.2 mol/L D.0.3mol/L
[例2]Fe和 Fe2O3的混合物,加入稀H2SO4溶液 100mL,放出H2 1.68L(标准状况)。Fe和 Fe2O3 均无剩余,向溶液中滴入KSCN溶液,未见颜色改变。为了中和过量的H2SO4,并使FeSO4 全部转化为Fe(OH)2 ,恰好消耗了3mol/L的NaOH溶液200mL,试求原硫酸溶液的物质的量浓度。
[例3] X、Y、Z为常见的三种单质,常温下X是固体,Y是液体,Z是无色气体。其反应关系如图所示,其中B的溶液显强酸性。

请回答下列问题:
(1)根据上述关系,确定X、Y、Z的化学式:X ,Y ,Z 。
(2)Y在元素周期表中的位置为 周期 族。
(3)写出A溶于水后加入X的离子方程式: 。
(4)写出C的溶液中通入过量Cl2的离子方程式: 。
[例4]X、Y、Z、W四种元素都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等;X的原子半径是自然界元素中原子半径最小的;W原子和Y原子的最外层电子数之和为Z原子最外层电子数的2倍,W原子最外层电子数为其电子层数的3倍。
(1)这四种元素的名称分别是X ,Y ,Z ,W 。
(2)写出由上述四种元素组成的既能与盐酸反应,又能与NaOH溶液反应的常见物质的化学式(各写一种)。无机物 ,有机物 。
(3)A、B、C、D分别是由X、Z、W中二种元素组成的常见的含有相同电子数的分子或离子,其中A是由5个原子组成,它们之间有如图所示的反应关系:
 ①A、B的电子式分别为:
①A、B的电子式分别为:
A ,B 。
B、C、D三种粒子结合质子的能力:
> > (用粒子符号表示),
其理由是
。
答案:例1 、C
例2、C(H2SO4)=3mol/L
例3、(1)X:Fe ;Y:Br2 ;Z:H2
(2)第4周期、ⅦA族
(3)2Fe3+ +Fe =3Fe2+
(4)2Fe2+ +4Br― +3Cl2 =2Fe3+ +2Br2
例4、(1)X、氢,Y、碳,Z、氮,W、氧
(2)无机物: (NH4)2CO3 或NH4HCO3
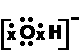 有机物:CH3COONH4
或CH2(NH2)COOH
有机物:CH3COONH4
或CH2(NH2)COOH
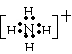 (3)① A、
,B、
(3)① A、
,B、
② OH― >NH3 >H2O
理由: OH― + NH4+ = NH3 ↑+H2O
NH3 + H3O+ = NH4+ +H2O
4.无机框图题


 无机框图题的一般解题思路是:迅速游览 产生印象 寻找突破口 注意联系
无机框图题的一般解题思路是:迅速游览 产生印象 寻找突破口 注意联系


 大胆设想 全面分析(正推和逆推) 验证确认。
大胆设想 全面分析(正推和逆推) 验证确认。
解题的关键是:依物质的特征或变化特征来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。因此应熟练掌握以Na 、Al、Fe 等金属为代表,非金属以S、Cl、N、C等为代表的元素及化合物相互转化的基础知识。
3.常见物质的反应现象
(1)火焰的颜色
a.H2在Cl2中燃烧:苍白色 b.CO、H2、CH4 在空气中燃烧:蓝色 淡蓝色
c.钠元素焰色反应:黄色(物理变化)
d.钾元素焰色反应:浅紫色(透过蓝色钴玻璃,物理变化)
(2有烟、雾或烟雾的现象
a.空气中出现白雾:HCl、HBr、HI、NH3、HNO3
b.空气中出现白烟:NH3与(HCl、HBr、HI、HNO3)
c.燃烧出现白色烟雾:P+Cl2
d. 燃烧出现棕黄色烟: Cl2 与(Cu 、Fe )
(3)沉淀颜色变化
Fe2+ (含Fe2+的溶液)遇碱液,沉淀颜色转变:白色变灰绿色变红褐色
(4)先有沉淀后沉淀消失
a.CO2或SO2通入澄清石灰水中, b. H3PO4 溶液滴入澄清石灰水中,
c. 含Al3+ 的盐溶液中滴入强碱溶液, d. 含AlO2― 的盐溶液中滴入强碱溶液.
(5) 具有唯一性的现象
a. 溶于水显碱性且遇湿的红色石蕊试纸变蓝的气体唯有NH3
b. 在空气中迅速由无色变为红棕色的气体唯有 NO
c. 在一定条件下能漂白有色物质的淡黄色固体唯有Na2O2
d. 在空气中能自燃的固体唯有 白磷
e. 遇SCN- 显红色的唯有Fe3+ ,遇OH― 生成红褐色沉淀的唯有Fe3+
f. 可溶于NaOH溶液的白色沉淀是Al(OH)3 ,
可溶于NaOH溶液的金属氧化物是Al2O3 。Zn(OH)2 、ZnO 不作要求。
g. 可溶于氢氟酸的酸性氧化物唯有SiO2
h.在冷的浓H2SO4或冷的浓HNO3中产生钝化现象的唯有Fe 和Al
i.同一元素的气态氢化物和最高价氧化物的水化物化合生成盐的元素唯有N元素。
(6)FeCl3 变色实验知多少
①向FeCl3 溶液中滴加几滴KSCN 溶液呈红色。
②FeCl3 溶液能使石芯试液呈红色。
③FeCl3 与NaOH 溶液反应,生成红褐色沉淀。
④向FeCl3 溶液中通入H2S 气体,生成淡黄色沉淀。
⑤向FeCl3 溶液中滴加几滴Na2S 溶液,生成淡黄色沉淀;当加入Na2S 溶液过量时,又生成黑色沉淀。
⑥向FeCl3 溶液中加入过量的铁粉,溶液变浅绿色。
⑦向FeCl3 溶液中加入过量的铜粉,溶液变蓝绿色。
⑧将FeCl3 溶液滴加到淀粉KI 溶液中,,溶液变蓝色。
⑨向FeCl3 溶液中加入苯酚溶液,溶液变紫色。
⑩将FeCl3 溶液滴加到AgNO3 溶液中,,有白色沉淀生成。
⑾将FeCl3 溶液与NaHCO3 溶液混合,放出气体,生成红褐色。
⑿将饱和FeCl3 溶液滴入沸水中,生成红褐色Fe(OH)3 。
2.常见与铁或铜及其化合物的颜色相同或相近的物质
红 : Fe2O3 Fe(OH)3 Fe(SCN)3 Cu2O Cu NO2 Br2(g)
黄 : Fe3+ 的溶液 Na2O2 S AgI AgBr Ag3PO4 Cl2 (黄绿)
绿 : Fe2+ 的溶液 FeSO4·7 H2O Cu2(OH)2CO3
紫 : ( Fe3+ 与苯酚作用的溶液) KMnO4 I2
黑 : Fe3O4 FeO FeS MnO2 CuO Cu2S CuS
白 : Fe(OH)2 Fe(银白) Al(OH)3 Mg(OH)2 BaCO3 BaSO4 AgCl
蓝 : Cu2+ 的溶液 CuSO4·5H2O
1.Fe(OH)2 制取
Fe(OH)2 极易被氧化,溶解在水中的少量O2都能将它氧化成Fe(OH)3 ,所以按一般方法很难得到Fe(OH)2白色沉淀。因此实验室中要解决的主要矛盾是防止Fe2+ 和Fe(OH)2被氧化。可采取的措施主要是:①采用新制备的纯亚铁盐溶液;②将溶解亚铁盐的蒸馏水煮沸除氧气;③在亚铁盐溶液表面加隔氧剂,如油或苯;④将碱直接加到亚铁盐溶液底部,使Fe(OH)2生成于溶氧少的部位。⑤通入不参加反应的气体排除空气,在此气氛中滴加强碱。
4、商余法及相对分子质量代换
利用有机物(主要是烃CxHy及烃的衍生物CxHyOz)的相对分子质量,采用“商余法”确定分子式。
对于CxHy用已知有机物的相对分子质量除以14(一个“CH2”基团的相对分子质量)或12(一个碳原子的相对质量),所得商就是该分子中“CH2”基团个数或碳原子个数。如除以14时有如下确定烃的规律:
(1)M/14能除尽时,烃为烯烃或环烷烃。
(2)M/14余数为2时,烃为烷烃。
(3)(M+2)/14能除尽时,或M/14余数为-2时,烃为炔烃。
(4)(M+6)/14能除尽时,或M/14余数为-6 时,烃为苯或其同系物。
若为烃的含衍生物,则依“商余法”求出烃的分子式后,用烃分子中的一个“CH4”代换为一个氧原子,如相对分子质量为44的烃,分子式为C3H8,若为烃的含氧衍生物,则是C2H4O。
※例题精析
[例1]两种气态烃组成的混合气体0.1mol,完全燃烧得到7.04g CO2和3.6gH2O,下列说法正确的是( )
A、一定有甲烷 B、一定是甲烷和乙烯 C、一定没有乙烷 D、一定有乙炔
[例2]将一定量的有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20g。滤液质量比原石灰水减少了5.8g,等量的此有机物与足量的金属Na反应,在标准状况下产生2.24L气体,则此有机物为 ( )
A、乙烯 B、乙烯 C、乙醇 D、乙酸
[例3]已知1mol某有机物含碳原子n mol,恰好完全燃烧时耗氧气1.5n mol。请回答有关问题:
(1)该有机物的化学式可能为:
① 、② 、③ 、④ 。
(2)若4.4g有机物(R)与足量的钠反应可收集到H2 560ml(标准状况),则构成该有机物的烃基可能有 种。
[例4]某种工业反应混合液仅由乙醚(C2H5OC2H5)与乙醇(C2H5OH)两种有机物组成。经化学成分分析测得此混合物中C、H、O三种元素物质的量之比为16∶a∶5。
(1)a的值为 ;
(2)此混合物中乙醚和乙醇物质的量之比为 ;
(3)取该混合物0.5mol完全燃烧时生成CO2和水,则消耗的O2物质的量为 。
[例5]一种混合气体,由一种烯烃A和一种烷烃B组成,它对氢气的相对密度为12。把1体积此混合气体和4体积氧气混合,放入密闭容器中,用电火花引燃,使两种烃都充分氧化,如果反应前后的温度都为150℃,测得容器内的压强由反应前的1个大气压增至燃烧后的1.04个大气压。则A、B各是什么烃?它们的体积分数各是多少?
答案:[例1]A、C [例2]B [例3](1)①CnH2n;②CnH2n+2O;(2)8种
[例4](1)42;(2)3∶2;(3)2.4mol
[例5]A为C4H8(1-丁烯或2-丁烯或2-甲基丙烯)占20%,B为CH4占80%。
3、等物质的量的有机物完全燃烧耗氧量、CO2及水的量的比较:
(1)烃燃烧的通式为:
CxHy+(x+y/4)O2→x CO2 +y/2 H2O
由上式可知等物质的量烃完全燃烧耗氧量是(x+y/4)决定,(x+y/4)越大,消耗氧气的量就越多。生成CO2的量由x决定,生成水的量由y决定。
(2)烃的含氧衍生物的化学式可以变换为烃与氧化物(水及二氧化碳)的组合形式,即CxHy(H2O)n(CO2)m。因为上式中的CO2、H2O都不消耗氧气,所以等物质的量的烃的衍生物完全燃烧消耗O2的量由CxHy部分决定。生成CO2的量由化学式中总的碳原子数决定,生成H2O的量由化学式中总的氢原子数决定。
2、 等质量的烃(CxHy)完全燃烧时,耗氧量、生成CO2和H2O的量的比较。
1molC(12g)消耗1mol O2,4molH(4g)消耗1mol O2,所以等质量的烃完全燃烧,H%越高,消耗O2的量越多,生成H2O量的越多,CO2越少。
依据上述分析可得如下规律:
(1)质量相同的烃,y/x越大,则耗氧量越多。若两种烃的y/x相等,质量相等,则耗氧量相同。
(2)质量相同的烃,y/x越大,则生成H2O的量越多,CO2的量越少。若两种烃的y/x相等,质量相同,则生成CO2和H2O的均相等。
(3)相同质量的有机物完全燃烧时,若有机物最简式相同,则所需O2的量相同,生成的CO2和H2O的量也相同。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com