
题目列表(包括答案和解析)
1. 石墨晶体(属混合型晶体)是层状结构,在每一层内;每一个碳原
石墨晶体(属混合型晶体)是层状结构,在每一层内;每一个碳原
子都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图
中7个六元环完全占有的碳原子数是( )
A.10个 B.18个 C.24个 D.14个
3.mg石墨中,正六边形数目为(m/12)NA÷2=(mNA/24)。
[拓展练习]
2.每一个碳原子都跟相邻的碳原子以共价键相结合。因此,每个六元环拥有碳原子(1/3)×6=2个,每个环拥有C-C键(1/2)×6=3个。
石墨型(如图6)
1.石墨晶体为层状结构。每一层中碳原子排列成六边形,一个个六边形(六元环)排列成平面的网状结构,键角120°。
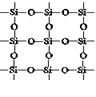
5.由上述推导过程可知:在二氧化硅晶体中,最小环为12元环(6个硅原子和6个氧原子),每个12元环实际拥有6×(1/12)=(1/2)个硅原子,拥有(1/6)×6=1个氧原子,故硅、氧原子个数比为1∶2。
4.硅晶体结构与金刚石晶体结构相同。
正四面体型 (金刚石、硅、二氧化硅)(如图4、图5) 1.金刚石晶体中,每个碳原子与4个相邻的碳原子形成4个C-C键。 2.在金刚石晶体中,由于一个碳原子所形成的4个键共有C42=6种两两相邻的组合,每个
键可形成两个近似垂直的六元环,故每个碳原子最多可形成6×2=12个六元环,一个六元环实际拥有6×(1/12)=(1/2)个碳原子。
3.在金刚石晶体中,固定一个C-C键,其余三键与该键有C31=3种两两相邻的组合,故一个C-C最多可形成3×2=6个六元环,每个六元环拥有6×(1/6)=1个C-C键。
3.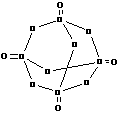 磷在空气中充分燃烧后生成结构如图所示的分子。图中圆圈表示原子、实线表示化学键。试回答:
磷在空气中充分燃烧后生成结构如图所示的分子。图中圆圈表示原子、实线表示化学键。试回答:
(1)请从图中找出磷原子,并在图上将其涂黑。
(2)形成化合物的化学式为 ________________。
(3)分子内的磷原子排列成______________形。
(4)每个磷原子处于______________中心。
(5)在用实线表示的化学键中,两原子间单线表示
的是 _________(填写非极性键或极性键)。
2.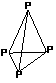 已知白磷是由P4分子形成的分子
已知白磷是由P4分子形成的分子
晶体,每个P4分子是正四面体结
构。分子中的四个磷原子位于正
四面体的四个顶点。则P4分子中
共有___________个P-P键。
干冰型(如图3)
 在干冰晶体中每个CO2分子周围紧邻的 CO2分子有_________个 在晶体中截取一个最小的正方形;使正方形的四个顶点落到CO2分子的中心,则在这个正方形的平面上有___________个C02分子。
在干冰晶体中每个CO2分子周围紧邻的 CO2分子有_________个 在晶体中截取一个最小的正方形;使正方形的四个顶点落到CO2分子的中心,则在这个正方形的平面上有___________个C02分子。
[拓展练习]
1.最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com