
题目列表(包括答案和解析)
17.在一定体积和一定条件下有反应N2(g)+3H2(g) 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
I.起始浓度 N2 l mol·L-1,H2 3 mol·L-1
II.起始浓度 N2 2 mol·L-1,H2 6 mol·L-1
下列叙述正确的是
A. I和II两途径达到平衡时,体系内各成分的体积分数相同
B.达到平衡时,途径I的反应速率v(H2)等于途径II的反应速率v(H2)
C.达到平衡时,途径I体系内混合气体的密度为途径II体系内混合气体的密度的
 D.达到平衡时,途径II体系内混合气体的压强是途径I内混合气体压强的2倍
D.达到平衡时,途径II体系内混合气体的压强是途径I内混合气体压强的2倍
16.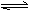 在恒温恒容的容器中进行反应N2O4(g) 2NO2(g);△H>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么,反应物浓度由0.06mol/L降到0.024mol/L,需反应的时间为
在恒温恒容的容器中进行反应N2O4(g) 2NO2(g);△H>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么,反应物浓度由0.06mol/L降到0.024mol/L,需反应的时间为
A.等于18s B.等于12s C.大于18s D.小于18s
15.在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,当有nmol电子转移时,下列说法不正确的是
A.有2/3nmol(NH4)2SO4分解 B.有 原子被还原
原子被还原
C.生成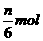 氧化产物 D.生成7nmolH2O
氧化产物 D.生成7nmolH2O
14.已知反应: ,下列说法正确的
,下列说法正确的
A.该反应不属于氧化还原反应 B.XeF4既是氧化剂,又是还原剂
C.反应中电子由Xe转移到C D.氧化剂与还原剂的物质的量之比为1:2
13.下列物质的溶液吸收SO2后,既无沉淀也无气体产生的是
①BaCl2 ②NaHCO3 ③Na2SO3 ④Na2SiO3 ⑤溴水
A.①②③ B.②③⑤ C.①③⑤ D.④⑤
12.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被Br-还原 D.HCN的电子式为 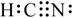
11.今有甲、乙、丙三瓶等体积等浓度的新制氯水,浓度均为0.1mol·l-1。如果甲瓶中加入少量的NaHCO3晶体m mol,在乙瓶中加入少量的NaHSO3晶体m mol,丙瓶不变,片刻后,甲、乙、丙三瓶中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>甲>丙
10.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-)
9.下列离子方程式中正确的是
A.NH4HSO4溶液中加入少量NaOH:NH4++OH-=NH3·H2O
B.饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
C.氢氧化镁溶于稀硫酸:Mg(OH)2+2H+=Mg2++2H2O
D.氯气通入Na2SO3溶液中:Cl2+SO32-+H2O=SO42-+2HCl
8.某无色透明的溶液中,放入铝片,立即有大量H2放出,则下列离子在溶液中可以大量存在的是
A.Ca2+、H2PO4-、Cl-、Na+ B.H+、Mg2+、 、Ba2+
、Ba2+
C.S2-、SO32-、K+、SO42- D.Na+、K+、ClO-、SO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com